Гальванический элемент.
Электрохимический ряд напряжений

Где Ек — потенциал катода; /Га — потенциал анода. Электрохимический процесс возможен, если ЭДС больше нуля. Для получения сравнимых значений величин электродных потенциалов были созданы электроды сравнения. Базисным электродом сравнения является нормальный водородный электрод (н. в. э.). Гальванический элемент позволяет определить электродвижущую силу ЭДС, которая характеризует возможность… Читать ещё >
Гальванический элемент. Электрохимический ряд напряжений (реферат, курсовая, диплом, контрольная)
Измерить электродный потенциал на металле в водном растворе экспериментально невозможно, так как для этого необходимо создать электрохимическую систему, включающую в себя два электрода, каждый из которых обладает собственным электродным потенциалом, поэтому составляют электрохимические системы — гальванические элементы, позволяющие определять сравнительную величину электродного потенциала.
Электрохимическая система состоит из двух электродов — анода и катода, соединенных друг с другом внутренней и внешней цепью. Роль внутренней цепи выполняет электролит, внешней — металлический проводник, соединяющий электроды. Различают два типа электрохимических систем — электролизеры и гальванические элементы. Рассмотрим особенности гальванических элементов.
Гальваническим элементом называется прибор (устройство), состоящий из катода, анода, внешней и внутренней цепи, в котором энергия химической реакции превращается в электрическую энергию.
Анод — электрод, на котором реализуется реакция окисления; в гальваническом элементе заряжен отрицательно.
Катод — электрод, на котором осуществляется реакция восстановления; в гальваническом элементе заряжен положительно.
Гальванический элемент позволяет определить электродвижущую силу ЭДС, которая характеризует возможность протекания электрохимических реакций. Величина ЭДС определяет восстановительную активность металла. ЭДС рассчитывают по формуле 
где Ек — потенциал катода; /Га — потенциал анода. Электрохимический процесс возможен, если ЭДС больше нуля. Для получения сравнимых значений величин электродных потенциалов были созданы электроды сравнения. Базисным электродом сравнения является нормальный водородный электрод (н. в. э.).
Нормальным водороднъш электродом называется система, состоящая из платинированной платиновой пластинки, помещенной в сосуд с серной кислотой, при этом активность катионов водорода равна 1 (pH = 0); через кислоту барбатирует («пробулькивает») очищенный молекулярный водород под давлением, равным одной атмосфере.
Схема н. в. э. изображена на рис. 3.2. Разность потенциала в н. в. э. на границе раздела фаз принята равной нулю. Платинированная платина — металлическая платиновая пластинка, покрытая слоем сильно измельченной платины — платиновой черни.
Платину платинируют для того, чтобы создать большую поверхность (в платинированной платине хорошо растворяется мо;
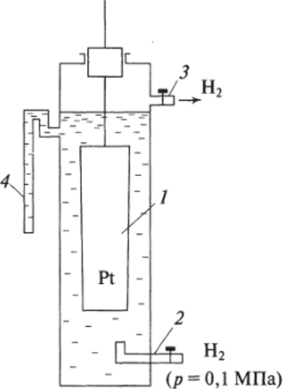
Рис. 3.2. Схема нормального водородного электрода:
/ — платинированная платиновая пластинка; 2 — стеклянная трубка для подачи водорода; 3 — трубка для отвода избытка водорода;
4 — трубка, заполненная электролитом для соединения с другим электродом.
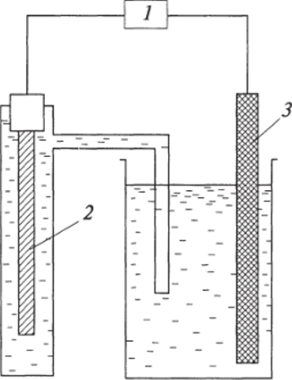
Рис. 3.3. Схема гальванического элемента для определения потенциала с помощью электрода сравнения:
- 1 — потенциометр;
- 2 — электрод сравнения (хлорсерсбряный и др.);
- 3 — рабочий электрод лекулярный водород, за счет чего возникает подобие твердого водорода).
Формула н. в. э.: в ионном виде: Pt || Н21| 2Н* дн = 101,3 кПа; я (Н+) = 1 моль/л; в молекулярном виде: Pt || Н21| H2S04
Существуют и другие электроды сравнения — каломельный, хлорсеребряный и др.
Для характеристики электрохимических потенциалов используют стандартные электродные потенциалы, для чего составляют гальванические элементы и измеряют их ЭДС при Т = 298 К, р = 0,1 МПа и с = 1 моль/л ионов в растворе.
Стандартным электродным потенциалом называется ЭДС гальванического элемента, образованного н. в. э. и электродом из данного металла, помещенного в раствор собственной соли, в котором активность катионов данного металла составляет 1 моль/л при Т = 298 К (схема гальванического элемента изображена на рис. 3.3).
Стандартные электродные потенциалы сведены в ряд и называются электрохимическим рядом напряжений, в него входит водород.
Электрохимический ряд напряжений — ряд металлов, включающий в себя водород, которые расположены в порядке возрастания положительного значения стандартного электродного потенциала (см. приложение 3).
Чем положительнее стандартный потенциал металла, тем менее активным восстановителем он является в водной среде и более активным окислителем является его катион. Так, атом меди является менее активным восстановителем (Е0 = +0,64 В), чем атом цинка (Е0 = -0,76 В), а катион меди — более активным окислителем, чем катион цинка. Электрохимический ряд напряжений применим только для процессов, протекающих в водной среде. Используя ряд напряжений, учитывают правило:
металл может вытеснять из водного раствора соли только те металлы, которые имеют большее положительное значение стандартного электродного потенциала, чем таковые для вытесняющего металла.
Так, железо может вытеснять медь из растворов ее солей, а медь — не может (почему 7).
Задания для самостоятельной работы
- 1. Назовите основные составные части гальванического элемента и поясните, почему его относят к электрохимическим системам.
- 2. Поясните, является (не является) знак заряда электрода признаком, определяющим его принадлежность: а) к аноду; б) к катоду.
- 3. Напишите формулу нормального водородного электрода и поясните его роль при изучении электрохимических процессов.
- 4. Поясните, может (не может) железо вытеснять магний из водных растворов его солей (ответ обоснуйте на основе расчета ЭДС гальванического элемента).
- 5. Поясните, какова роль гальванических элементов в строительстве.