Стандартный водородный электрод.
Ряд стандартных электродных потенциалов

Потенциалов между металлом и раствором его соли. Почему же вместо определенного значения потенциала используется их разность? В данном случае ситуация аналогична той, с которой мы имели дело в гл. 10, обсуждая проблему измерения внутренней энергии 1/. Потенциал <�р, так же как и II, зависит от системы отсчета, но разность потенциалов между двумя точками абсолютна и не зависит от того, каким путем… Читать ещё >
Стандартный водородный электрод. Ряд стандартных электродных потенциалов (реферат, курсовая, диплом, контрольная)
Физический смысл величины электродного потенциала 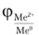 — разность
— разность
потенциалов между металлом и раствором его соли. Почему же вместо определенного значения потенциала используется их разность? В данном случае ситуация аналогична той, с которой мы имели дело в гл. 10, обсуждая проблему измерения внутренней энергии 1/. Потенциал <�р, так же как и II, зависит от системы отсчета, но разность потенциалов между двумя точками абсолютна и не зависит от того, каким путем произведено измерение этой разности.
Появляется возможность практического использования уравнения Нернста, поскольку во всех процессах физически значимой является не величина потенциала отдельного электрода, а величина разности потенциалов между электродами электрохимической системы. Поэтому в электрохимии принята система относительных электродных потенциалов, которая основана на приписывании стандартному электроду потенциала, равного нулю. Тогда по уравнению АЕ = срк — сра, приняв значение потенциала одного из электродов за нуль отсчета, находят относительный электродный потенциал исследуемого электрода. В качестве электрода сравнения, потенциал которого принимается за нуль отсчета (но предложению В. Нернста), принят стандартный водородный электрод. На нем протекает равновесный окислительно-восстановительный процесс.
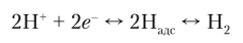
Стандартный водородный электрод представляет собой сосуд, заполненный нелетучей кислотой (как правило, серной), в котором находится платиновая пластинка (рис. 16.3). Она предназначена для адсорбции молекулярного водорода, который на ее поверхности диссоциирует на атомы. Заметим, что металлическая платина — проводник первого рода, поставляющий в систему свободные электроны. Концентрация кислоты соответствует ян+ = 1 моль/л, парциальное давление водорода в системе поддерживается 105 Па.
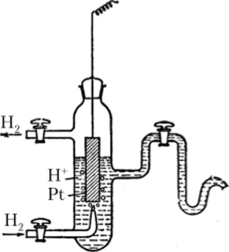
Рис. 16.3. Конструкция водородного электрода.
В этих условиях по соглашению принято = О при любой температуре.
ТТ Для измерения относительного потенциала электрода создают электрохимическую систему из измеряемого и стандартного водородного электрода (рис. 16.4). Водородный электрод в зависимости от природы измеряемого электрода может являться как анодом, так и катодом. В любом случае АЕ = фк — фа такого гальванического элемента в стандартных условиях будет равна. Водородный электрод позволяет измерить относительный потенциал 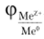 с точностью до 0,1 В. Однако в эксплуатации водородный электрод является сложным и «капризным» устройством, поэтому практически вместо него используют другие электроды с известным значением стандартного потенциала, например каломельный или элемент Вестона. В общем случае потенциал водородного электрода при температуре 25 °C равен
с точностью до 0,1 В. Однако в эксплуатации водородный электрод является сложным и «капризным» устройством, поэтому практически вместо него используют другие электроды с известным значением стандартного потенциала, например каломельный или элемент Вестона. В общем случае потенциал водородного электрода при температуре 25 °C равен 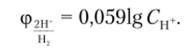
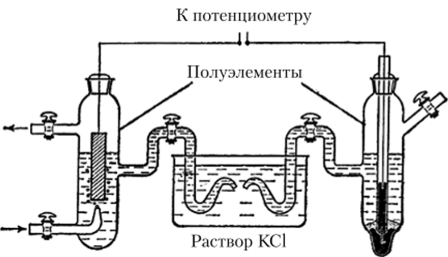
Рис. 16.4. Схема измерения стандартного электродного потенциала:
слева — стандартный водородный электрод, справа — измеряемый Или с учетом того, что pH = -1й Сн+, получаем.
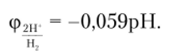
Измеряя электродный потенциал, можно определить pH раствора. Это и осуществляется в современных приборах, называемых рН-метрами. Отсюда очевидно, что потенциал водородного электрода 2Н+/Н2 в чистой воде с pH = 7 равен -0,413 В.
Проведенная большая экспериментальная работа позволила установить значения электродных потенциалов для всех металлов и многих сплавов. Данные, но электродным потенциалам соответствуют ряду активности металлов (рис. 16.5). Впервые такой ряд построил российский химик Николай Николаевич Бекетов (1827—1911).

Рис. 16.5. Часть ряда Н. Н. Бекетова активности металлов около условной нулевой точки — потенциала водорода.
Анализ этого ряда показывает, что:
- • при перемещении слева направо возрастает окислительная способность катионов Ме2+, а при движении справа налево возрастает восстановительная способность металлов Ме;
- • водород из кислот могут выделять металлы, стоящие левее него, но чистую воду с выделением водорода могут разлагать только металлы, более активные, чем железо;
- • если металл не взаимодействует с водой, он вытесняет из растворов солей все металлы, стоящие правее него в ряду напряжений.