Механический состав почв и явления коагуляции

Выводов по отношению к почвенным процессам из этих данных, как нам кажется, сделать нельзя, так как трудно ожидать, чтобы в почвах могли встретиться свободные и притом хорошо растворимые кислоты в сколько-нибудь значительных концентрациях, за исключением, может быть, тех случаев, когда в почве есть выветривающийся серный колчедан или окисляющаяся сера. Тогда может временно появиться свободная… Читать ещё >
Механический состав почв и явления коагуляции (реферат, курсовая, диплом, контрольная)
Изучение механического состава почвенных масс, несмотря на сравнительно малую точность употребляющихся для этой цели методов исследования, имеет все же, в соединении с некоторыми другими определениями, большое значение. Когда изучаются со стороны механического состава отдельные горизонты одного и того же почвенного разреза, то получается возможность судить о том, переносятся ли при почвенном процессе мелкоземистые частицы из одного горизонта в другой. Когда изучается параллельно механический состав различных почв какой-либо территории и их материнских пород, особенно принадлежащих к группе наносов, то становится возможным классифицировать почвы данной территории на глинистые, суглинистые, супесчаные и песчаные, а также до некоторой степени судить о способе происхождения материнских пород (наносов), на которых почвы образовались.
Все существующие методы почвенного механического анализа1 дают возможность разделить взятую навеску почв на ряд групп, отличающихся величиной своих частичек, при чем, однако, не все исследователи придерживаются однородной терминологии в обозначении частичек различных размеров, как это видно из прилагаемой таблицы.
Величина частиц | Кноп | Лоренц | Фадеев | Осборн | ||
> 10 мм 10—7 7—5 5—3 3—2. | Скелет. | Камни и хрящ. | Камни. | Крупнозем. | ||
Хрящ. | Крупный Средний Мелкий. | Каменистые. | ||||
1 Мы не имеем возможности описывать здесь многочисленные методы и аппараты для механического анализа, отсылая читателя к соответственным работам, сообщенным в списке литературы. Прекрасная обстоятельная сводка методов механического анализа приведена в работах Зауербрея и Глушкова В. Г. Кроме того обзор методов механического анализа можно найти в работах Астапова, Зильбермюнца и Кленова (ом.
список литературы
).
Окончание таблицы
Величина частиц. | Кноп. | Лоренц. | Фадеев. | Осборн. | |||
| Песок. | Крупный Средний Мелкий Тонкий. | Песок. | Крупный Средний Мелкий. | Песчаные. | ||
<0,0015. | Мелкозем. | Пыль. | Пыль. | Крупная Мелкая. | Землистые. | Песок. | |
Глина. | Ил. | Крупный Средний Мелкий. | Ил. | ||||
Пыль и глина. | |||||||
При исследовании почв Нижегородской губ. принято было следующее обозначение:
Скелет. | >2 мм. | хрящ. |
2—1. | крупный песок. | |
1—0,5. | средний «. | |
0,5—0,05. | мелкий «. | |
Мелкозем. | 0,05—00,1. | пыль. |
0,01 и мельче. | ил (глина). |
Согласно Фаддееву, ил может быть разделен на группы (см. таблицу).
Аттерберг предложил иной принцип классификации почвенных частичек, получаемых при механическом анализе. Он нашел опытным путем, что между отдельными величинами зерен можно, на основании физических свойств, установить три границы, а именно:
- 1) Зерна размерами в 0,2 мм[1] представляют границу водопроницаемости, так как, начиная с этой величины, они уже сильно задерживают воду.
- 2) Зерна размерами в 0,02 мм представляют предел коагуляции (свертывания) в слабых соляных растворах.
- 3) Зерна размерами 0,002 мм представляют границу Броуновского движения.
Вместе с тем оказывается, что песок крупнее 2 мм обладает совсем незначительной капиллярностью; хорошую капиллярность обнаруживают частички размерами 0,2—0,02, у частичек же 0,02—0,002 очень высокая капиллярность, но все более замедляющееся движение воды по капиллярам. Более тонкие частички обнаруживают очень замедленмое движение и могут на поверхности совсем высохнуть, сохраняя, однако, запас воды в глубине.
На основании изложенного, Аттерберг предлагает следующую классификацию:
Хрящ. | Грубый. | 20—6 мм. |
Мелкий. | 6—2″. | |
Песок. | Грубый. | 2,0—0,6 «. |
Более мелкий. | 0,6—0,2 «. | |
Песок. | Очень тонкий. | 0,2—0,06 «. |
Песчаная пыль. | 0,06—0,02 «. | |
Суглинок (ил). | Шлуф. | 0,02—0,006 «. |
Schlick. | 0,006—0,002 «. | |
Глина. | мельче 0,002 «. |
Эту последнюю фракцию в более поздней работе Аттерберг называет коллоидным илом, разделяя ее еще так: частички от 0,002—0,0006 мм — грубый коллоидный ил, а частички мельче 0,0006 мм — тонкий коллоидный ил. Давая такие названия, Аттерберг основывается на данных Szigmondy, согласно которому частички грубые 0,25 мм называются субмикронами[2], т. е. относятся уже к категории частичек, обнаруживающих свойства коллоидов. Так как при этом граница как броуновского движения, так и пластичности, по данным Аттерберга, лежит между 0,005—0,002 мм, то и предел обнаружения коллоидных свойств Аттерберг полагает между этими размерами частичек.
Броуновское движение. Тончайшие частички почвенного ила, будучи помещены в капле воды на предметное стекло, обнаруживают под микроскопом так называемое броуновское движение. Явления, наблюдаемые здесь, по мнению физиков (Perrin), аналогичны тем движениям, какие принимаются для газовых частиц, наполняющих какой-либо сосуд.
Броуновское движение у коллоидов значительно интенсивнее, чем у суспензий, и приближается иногда к скоростям движущихся молекул.
Броуновское движение обнаруживается не только в воде, но и в других жидкостях.
[Броуновское движение, при котором коллоидные частички приближаются одна к другой, может способствовать их соединению в аггрегаты и их коагуляции (см. ниже). Но имеющиеся на поверхности частичек электрические заряды, наоборот, могут вызвать их взаимное отталкивание, противодействовать, таким образом, коагуляции и обусловить устойчивость дисперсной системы].
Коагуляция суспензий и коллоидов. Говоря о коллоидных свойствах мельчайших почвенных частиц, мы имеем в виду их способность коагулировать, т. е. стягиваться, свертываться под влиянием электролитов.
Давно уже было замечено, что если на почвенные суспензии, взмученные в воде, действовать растворами электролитов, то суспензии свертываются, собираясь в более крупные хлопья, и падают на дно сосуда. Такое явление получило название коагуляции.
Старые исследования, появившиеся еще до развития коллоидной химии (работы Шульце, Шеерера, Шлезинга, А. Майера, Бодлендера, Гильгарда и др.), установили:
- 1) что электролиты способны свертывать или коагулировать почтенные суспензии, а неэлектролиты коагуляции не вызывают;
- 2) что коагуляция появляется лишь тогда, когда раствор электролита достиг определенной концентраций, ниже которой этот раствор не обнаруживает действия (так называемый ныне электролитический порог);
- 3) что величина концентрации для различных электролитов различна;
- 4) что растворы, в которых находится ион гидроксил (ОН), делают почвенные суспензии устойчивыми.
Согласно теории коагуляции, развиваемой Фрейндлихом[3], [электрокинетический потенциал частичек обусловлен двойным электрическим слоем, при чем у отрицательно заряженных коллоидов (к которым относятся и большинство почвенных коллоидов) внешний диффузный слой образован катионами, а внутренний, находящийся непосредственно на поверхности частички, анионами.
При прибавлении, напр., ВаС12, отрицательно заряженный коллоид абсорбирует преимущественно ионы Ва и в результате происходит понижение потенциала частички; те катионы, которые были ранее в диффузном слое, переходят в раствор на место ионов Ва; коагуляция наступает тогда, когда потенциал частичек достигает определенного (критического) значения. Для понижения потенциала до критического значения нужно эквивалентное количество ионов различной валентности, т. е., иными словами, количества абсорбированных ионов различных металлов, вызывающих коагуляцию отрицательных коллоидов, должны быть эквивалентны. Однако опыты подтверждают лишь приблизительную эквивалентность абсорбции ионов-коагуляторов.
По теории Смолуховского и Жигмонди, коагуляция происходит при определенной величине потенциала частичек. Этот потенциал носит название первого критического потенциала. Дальнейшее понижение потенциала ведет к быстрой коагуляции, и здесь мы имеем второй критический потенциал. Если коагуляция происходит при условии только броуновского движения, при каковом вероятность столкновения частиц друг с другом во всех направлениях одинакова, она носит название перикинетической коагуляции (Wiegner). В тех же случаях, когда преобладает вероятность столкновения частиц в каком-либо одном направлении (например, действ, центробежной силы, силы тяжести и т. п.), коагуляция носит название ортокинетической.
Из более ранних работ по коагуляции суспензий электролитами заслуживает внимания работа Машгаупта. Далее в опытах Hall’a и Morrison’a было показано, что из катионов наиболее энергично коагулирует водород].
Относительная способность коагуляции частичек каолина под влиянием различных катионов показана в нижеследующей таблице:

Наиболее обстоятельные исследования по вопросу о действиях; электролитов на илистые суспензии были произведены К. К. Гедройцем. Исследователь оперировал с красной глиной, которая отмучивалась в чашках с водой (высота воды — 7,5 см), и мутная жидкость сливалась в бутыль. Из этой бутыли бралась суспензия, которая не осаждалась в течение трех дней, и эта суспензия служила затем для опытов.
В цилиндрические сосуды (Несслера) с отметками в 50 и 100 куб. см помещалось 50 куб. см суспензии и такой же объем изучаемого раствора электролита. После этого содержимое цилиндра взбалтывалось и цилиндр устанавливался на штатив.
Наблюдение заканчивалось через двое суток, хотя во всех случаях, когда происходила коагуляция, она завершалась вполне уже в течение одних суток.
На первую очередь было поставлено изучение коагулирующего действия кислот, при чем испытывались как минеральные (соляная, азотная, серная, ортофосфорная) так и органические кислоты (муравьиная, лимонная, щавелевая, уксусная). Результаты опытов сведены в нижеследующей таблице, которая показывает величины концентрации, выраженные в долях нормальности.
Кислоты. | Полное свертывание суспензии. | Неполное свертывание суспензии. | Свертывания нет (электролитический порог). |
Соляная. | 0,005—0,0025. | 0,005—0,0005. | 0,001—0,0005. |
Азотная. | 0,005—0,0025. | 0,005—0,0005. | 0,0015—0,0005. |
Серная. | 0,005—0,0025. | 0,005—0,0005. | 0,0015—0,0005. |
Ортофосфорная. | 0,025—0,005. | 0,025—0,0025. | 0,005—0,0025. |
Муравьиная. | 0,1—0,005. | 0,05—0,005. | 0,0125—0,005. |
Лимонная. | 0,125—0,05. | 0,125—0,025. | 0,05—0,025. |
Щавелевая. | > 0,5. | >0,5—0,025. | немного ниже 0,02. |
Уксусная. | 0,5—0,25. | 0,5—0,125. | 0,25—0,125. |
Из приведенных цифр видно, что сильные кислоты (соляная, азотная, серная) действуют почти одинаково и притом наиболее энергично по сравнению с другими кислотами; слабее действует ортофосфорная? кислота, а еще слабее органические кислоты.
Выводов по отношению к почвенным процессам из этих данных, как нам кажется, сделать нельзя, так как трудно ожидать, чтобы в почвах могли встретиться свободные и притом хорошо растворимые кислоты в сколько-нибудь значительных концентрациях, за исключением, может быть, тех случаев, когда в почве есть выветривающийся серный колчедан или окисляющаяся сера. Тогда может временно появиться свободная серная кислота, пока она не будет связана каким-нибудь основанием. Что касается органических кислот, входящих в состав почвенного перегноя, то они, во-первых, значительно менее подвижны, чем исследованные К. К. Гедройцем органические кислоты, а, во-вторых, их концентрация слишком слаба для того, чтобы можно было допустить какое-либо коагулирующее их действие. И на самом деле, в наименее насыщенных основаниями почвах, каковыми являются подзолы, никакой коагуляции суспензий в поверхностных горизонтах почвы не наблюдается: эти почвы всегда бесструктурны. Муравьиную и щавелевую кислоты, хотя и находили иногда в почвах, но находили обычно в виде солей, а не в свободном состоянии, и вообще трудно думать, чтобы какая-либо кислота могла продолжительное время существовать в свободном состоянии в почвах, кроме слабых и мало подвижных кислот почвенного перегноя и углекислоты. Тем не менее, конечно, указанные опыты не теряют своего интереса и значения.
Изучение коагулирующего действия щелочей еще более интересно, так как случаи появления в некоторых почвах (солонцы) гидроксильного иона далеко не представляют редкости. К. К. Гедройцем были испытаны едкая известь и едкий натрий, при чем результаты получились следующие:
Щелочи. | Полное свертывание суспензии. | Неполное свертывание суспензии. | Свертывания нет (электролитический порог). |
Едкая известь. | 0,0040—0,0020. | 0,001—0,0005. | 0,001—0,0005. |
Едкий натрий. | ок. 0,05. | 0,05—0,0225. | ок. 0,0225. |
Особенно интересны опыты над коагуляцией суспензий с помощью солей. Для хлористых солей однозначных металлов получены нижеследующие результаты, показывающие, что ни одна из этих солей не имеет столь сильного коагулирующего действия, как соляная кислота, т. е. что ион водорода обладает значительно большей коагулирующей способностью, чем ионы однозначных металлов.
Соли | Полное свертывание суспензии | Неполное свертывание суспензии | Свертывания нет (электролитический порог) |
Хлористый литий. | 0,125—0,05. | 0,125—0,0125. | 0,025—0,0125. |
" аммоний. | 0,125—0,05. | 0,125—0,0125. | 0,025—0,0125. |
" натрий. | 0,125—0,05. | 0,125—0,0125. | 0,025—0,0125. |
" калий. | 0,125—0,05. | 0,125—0,0125. | 0,025—0,0125. |
" рубидий. | 0,05—0,025. | 0,05—0,005. | 0,0125—0,005. |
Азотнокислое серебро. | 0,025—0,0125. | 0,025—0,0025. | 0,005—0,0025. |
Из всех испытанных хлористых солей наибольший интерес для почвоведа представляет соль натрия, так как натровые соли чаще всего встречаются в почвах как в виде хлористой, так и в виде сернокислой. Соли калия в почвах находятся значительно реже и в меньших количествах.
Минимальное количество хлористого натрия в растворе, могущее вполне коагулировать суспензии, равно 0,05 норм., что соответствует 2,925 г на литр воды. Такие концентрации солей в некоторых солончаках, повидимому, возможны.
Для солей двузначных металлов результаты, полученные Гедройцем, таковы:
Соли | Полное свертывание суспензии | Неполное свертывание суспензии | Свертывания нет (электролитический/ порог) |
HgCl. | не свертывается вовсе. | ||
MgCl2. СаС12, SrCl2, CdCl2, ВаС12, MnCl2, NiCl2, СоС12 | 0,005—0,0025. | 0,005—0,0005. | 0,125—0,0005. |
CuCl2 |
|
| 0,0005—0,25. |
Из этих цифр видно, что двузначные ионы, в качестве коагуляторов, действуют столь же энергично, как ион водорода соляной кислоты, откуда следует, что приведенные выше данные Hall’a и Morrison’a не являются достаточно точными, так как, согласно этим данным, коагулирующая способность иона водорода чуть не в четыре раза больше, чем Ионов Са и Mg.
При исследовании вопроса о коагулирующем действии солей железа и алюминия Гедройцем было наблюдено особое явление (это больше всего касается соли железа — FeCl3), которое и раньше было известно из работ Бехгольда1, Нейснера, Фридемана1[4][5] и Бекстона[6] с сотрудниками. Явление заключалось в том, что при действии на суспензии раствора FeCl3 отмечаются две концентрации с максимальной коагулирующей способностью, в промежутке которых свертывания не происходит. Такое «явление зон» объясняют тем, что из растворов хлорных железа и алюминия выделяются коллоидные гидраты окисей, несущие положительный электрический заряд. Эти коллоиды, покрывая частицы суспензий или абсорбируясь ими, дают положительно заряженные частички, которые осаждаются уже анионом, раствора. В силу этого концентрация электролита должна повыситься настолько, чтобы перейти соответственный электролитический порог.
В опытах Гедройца с FeCl3 между концентрациями 0,01 и 0,001 н. обнаружена была зона неосаждаемости, а выше этой концентрации (1,0—0,025) и ниже ее (0,001—0,0005 н.) происходит коагуляция. Хлористый алюминий, при концентрации в цилиндре около 0,125 норм, и ниже ее, не осаждает суспензии, при концентрации около 0,25 н. и выше вполне осаждает, а между 0,25 и 0,125 вызывает неполное осаждение.
Подводя итоги вышеописанным опытам, Гедройц делает такие выводы:
- 1) Слабое действие HgCl2 и органических кислот зависит от малой степени их электролитической диссоциации и характера катиона.
- 2) Из остальных испытанных электролитов наименьшей коагулирующей способностью отличается едкий натрий.
- 3) У солей с одинаковым анионом обнаруживается неодинаковая способность коагуляции: она тем больше, чем выше валентность катиона. Так, двухвалентные катионы коагулируют при меньших концентрациях, чем одновалентные, но при больших, чем трехвалентные.
- 4) Действие соляной кислоты (ион водород) сильнее, чем хлористых солей с одновалентными ионами, и приближается по силе к хлоридам с двухвалентными катионами.
Далее исследователь поставил вопрос о влиянии кислотности и щелочности на свертывающую способность солей. Испытывалось действие кислотности на растворы солей NaCl и СаС12, при чем в качестве кислоты служила серная кислота. В опыте с NaCl, раствор которого имел концентрацию 0,0125 норм., т. е. такую, при которой раствор этой соли уже не вызывает коагуляции, концентрация серной кислоты менялась от 0,001 н. до 0,25 н., т. е. опять-таки в тех пределах, в которых серная кислота, сама по себе, коагуляции — суспензии не вызывает. Оказалось, что концентрация серной кислоты в пределах 0,001—0,75 н., в присутствии раствора 0,0125 н. хлористого натрия, вызывает коагуляцию суспензий, при чем концентрация 0,75 н. дает неполную коагуляцию, осаждая, однако, большую часть суспензии.
В опыте с СаС12 бралась концентрация соли 0,0005 н., а концентрации кислоты те же, что и в предыдущем опыте с NaCl. Результаты получились те же, что и с хлористым натрием.
Из этих опытов вытекает заключение, что смесь соли и кислоты обладает большей коагулирующей силой, чем сумма соли и кислоты, взятых в отдельности, иначе говоря, прибавка ничтожной концентрации кислоты к раствору соли значительно повышает силу коагуляции.
Не останавливаясь подробно на опытах, имевших своей целью выяснить влияние щелочности на свертывающую способность солей, отметим лишь общие выводы, полученные исследователем. Эти выводы таковы:
- 1) Едкий натрий и средняя сода коагулируют суспензии слабее, чем хлористый натрий, тогда как едкая известь коагулирует более энергично, чем хлористый кальций.
- 2) Осаждающая способность солей в концентрациях, лишь немного превышающих величину электролитического порога, понижается в присутствии небольшого количества едкого натрия и соды. Подобное действие щелочи обнаруживается в этом случае еще и тогда, когда эта щелочь прибавлена в ничтожном количестве.
- 3) Едкий натрий в концентрациях между 0,01—6,0005 норм, увеличивает устойчивость суспензии, препятствуя самопроизвольному ее осаждению.
Далее исследовалась осаждающая способность углекислых солей натрия, при чем оказалось, что если выразить концентрацию растворов едкого натрия, углекислого и двууглекислого натрия в натрии, который все они содержат, то их коагулирующая способность по отношению к илистой суспензии приблизительно одна и та же, несмотря на то, что, казалось бы, те из указанных соединений, которые дают в водном растворе ионы (ОН) т. е. едкий натрий и в меньшей степени Na2C03, должны обнаруживать меньшую способность коагулирования. Возможно, как полагает исследователь, одной из причин такого противоречия между наблюдением и предположением является неодинаковая степень электролитической диссоциации у изученных соединений. Электролитический порог для Na2C03 лежит в пределах 0,05—0,025 норм.
Что касается коагулирующей способности кальциевых солей, то исследование этого вопроса дало такие результаты:
Электролитический порог | ||
в нормальн. един. | в % | |
СаС12 | 0,125—0,0005. | 0,047—0,019. |
Са (Ш3)2 | ниже 0,125. | ниже 0,047. |
Са (ОН)2 | 0,001—0,0005. | 0,037—0,019. |
CaS04 | ниже 0,125. | ниже 0,047. |
Са (НС03)2 | «> 0,125. | " 0,047. |
Исследователь сопровождает эти цифры, указывающие на одинаковую приблизительно способность кальциевых солей коагулировать илистые суспензии, замечанием, что на самом деле осаждающая способность этих солей должна более или менее различаться в зависимости от степени их электролитической диссоциации и рода аниона.
Попытки выяснить вопрос об обратимости или необратимости коагуляции илистых суспензий также были сделаны Гедройцем. Обратимый характер, коагуляция почвенных суспензий имела бы в том случае, если бы получившийся при коагуляции осадок мог бы вновь восстановить степень своей дисперсности при уничтожении той силы, которая эту дисперсность нарушила.
Гедройц поставил опыты по изучению осадков илистых суспензий, свернутых раствором NaCl, СаС12, ВаС12 и FeCl3, при чем оказалось, что суспензия, свернувшаяся под влиянием NaCl, возвращается в первоначальное состояние, если раствор NaCl удален и замещен таким же объемом воды. После действия НС1, СаС12 и ВаС12 возвращение к дисперсному состоянию происходит лишь частично, а при осаждении хлорным железом полученный осадок совершенно не способен вернуться к дисперсному состоянию.
Наконец, в работе Гедройца подверглись изучению вопросы о зависимости коагулирующего действия электролитов от степени дисперсности почвенной суспензии, а также и от ее концентрации.
Уже из теории коагуляции должно следовать, что уменьшение размера частичек суспензии, повышающее величину поверхности этих частичек, должно вызвать увеличение электрического заряда суспензии, а потому для нейтрализации этого заряда потребуется и большая концентрация электролита. Это положение подтверждено было и опытным путем, который определенно показал, что «величина электролитического порога находится в зависимости от степени дисперсности суспензии: чем мельче почвенные частицы, тем выше та предельная концентрация электролитов, при которой они вызывают еще свертывание частиц, тем устойчивее суспензия».
Что же касается скорости коагулирующего действия электролитов, то она также находится в зависимости от степени дисперсности суспензии, при чем зависимость эта обратная при концентрации электролитов, не сильно превышающих величину электролитического порога, и прямая — в противном случае.
Понижая концентрацию илистой суспензии, тем самым уменьшают скорость коагуляции этой последней. Это понятно, так как чем больше расстояние между частицами в водной среде, тем больше требуется времени на то, чтобы эти частички могли соединиться в группы, после чего собственно и происходит их опускание на дно сосуда.
Сделанные Гедройцем наблюдения и выводы потребуют, несомненно, различных поправок и оговорок, если от суспензий чистой глины мы перейдем к суспензиям различных почв, где, помимо нейтральных в химическом смысле частичек глины, мы можем встретить гумусовые коллоиды, различные соли и частички силикатов и алюмосиликатов, отщепляющих основания при соприкосновении с водой. Опыты Проневича, произведенные в моей лаборатории, показали, что суспензии подзолов, чернозема, солонца значительно различаются между собой в способности коагуляции под влиянием электролитов.
В последнее время опубликованы интересные наблюдения Я. Я. Витынь1 над коагуляцией суспензий из глеевого суглинка, горизонтов подзолистой почвы, мергелистого суглинка и лугового известняка. Коагуляторами служили H2S04, ССХ, Са (НО)2, NaHC03, NaCl, CaS04, Са (НС03)2, Са (НС03)2 + NaHC03.
Мы не можем здесь исчерпать богатого содержания работы Витыня и отметим лишь некоторые моменты.
Суспензии глеевой почвы характеризуются не только ненасьнценностью (присутствие ионов Н), но и содержанием поглощенных ионов К и Na; последние следует считать важнейшими факторами, повышающими степень дисперсности глинистых суспензий этих почв и уменьшающими их чувствительность по отношению к электролитам. Отсюда видно, что катионы, поглощенные суспензиями или гидролитически отщепляющиеся от силикатов и алюмосиликатов, оказывают большое влияние на чувствительность суспензий к электролитам.
Тормозящее действие на коагуляцию суспензий раствора NaHC03, особенно велико в тех случаях, когда почва нуждается в кальции (т. е. является ненасыщенной). Автор объясняет это тем, что здесь происходит образование Na2C03, благодаря чему, в конечном итоге, появляются стабилизирующие ионы (ОН).
Кроме того, отрицательное влияние NaHC03 заключается в том, что эта соль тормозит растворение Са (НС03)2.
Общие положения, которые могли быть высказаны по отношению к илистым суспензиям, могут быть отнесены и к почвенным коллоидам, так как между теми и другими резкой разницы нет. Коллоиды, как мы знаем, являются системами более высоко дисперсным, а поэтому все то, что в предыдущем исследовании относится к частицам с повышающейся дисперсностью, должно также относиться и к коллоидам.
Так, еще старые исследования свойств почвенного перегноя показывают, что последний переходит в состояние золя в присутствии гидроксильных ионов. На этом отчасти основывается способ извлечения из почвы перегноя с помощью раствора соды. Говорим «отчасти», так как не исключена возможность образования растворимых натриевых солей. Зола гумуса коагулируется минеральными кислотами (действие иона водорода), хотя наиболее высокодисперсные составные части почвенного перегноя остаются при этом в состоянии золя и могут быть коагулированы солями тяжелых металлов (напр., меди). И здесь, однако, возможность образования солей не исключена.
Условия коагуляции золя гидрата окиси железа, содержащего 0,295 г Fe203 в 1 куб. см, изучались Аарнио1[7][8]. В одном из своих опытов он брал раствор серной кислоты, содержащей в 1 куб. см 0,442 г SO" 3, и получил следующие результаты:
Раствор SO" 3 | Золь гидрата Fe2Os | Раствор SO" 3 | Золь гидрата Fe2Os | |
5 куб. см. | 0,1 куб. см. | 2 куб. см. | 0,1 куб. см. | Осадка нет. |
2 ««. | 0,2 ««. | 2 ««. | 1,0 ««. | Получается осадок. |
2 ««. | 0,3 ««. | 2 ««. | 5,0 ««. | |
2 ««. | 0,5 ««. | 2 ««. | 9,0 ««. | |
2 ««. | 6,0 ««. | 2 ««. | 10,0 ««. | Осадка нет. |
2 ««. | 7,0 ««. | —. | —. | |
2 ««. | 8,0 ««. |
Таким образом, ион S04 осаждает гидрат окиси железа в отношениях lFe2Os: 1,49S03 до lFe203:0,06S03.
Опыт с фосфорной кислотой (в 1 куб. см 0,8 498 г Р205) дал такие результаты:
Золь гидрата Ре2®з. | Фосф. к-та. | Золь гидрата Fe2®3. | Фосф. к-та. | |
2 куб. см. | 0,1 куб. см. | 2 куб. см. | 0,3 куб. см. | Осадка нет. |
2 ««. | 0,2 ««. | 2 ««. | 0,4 ««. | |
2 ««. | 0,5 ««. | 2 ««. | 20,0 ««. | Получается осадок. |
2 ««. | 1,0 ««. | 2 ««. | 40,0 ««. | |
2 ««. | 5,0 ««. | 2 ««. | 50,0 ««. | |
2 ««. | 10,0 ««. | 2 ««. | 100,0 ««. | |
2 ««. | 105,0 ««. | 2 ««. | 110,0 ««. | Осадка нет. |
Этот опыт дает пределы колебаний от 1 Fe209:0,07Р2Об до 1 Fe203: 14,40Р2Об. Наконец, опыты осаждающим действием раствора Са (НС03)2 на золь гидрата окиси железа (в 1 куб. см 0,412 СаО) дали колебания от 1 Fe203: 0,02СаО до 1 Fe203 :2,81СаО.
Коагуляция золя гидрата окиси алюминия изучалась Аарнио по отношению к тем же ионам, как и для гидрата окиси железа.
В опыте с серной кислотой (в 1 куб. см 0,442 г S03) и золем гидрата А1303 (0,82 А1203 в 1 куб. см) получились такие результаты:
Серная к-та. | Золь гидрата А12о3 | Серная к-та. | Золь гидрата. ai2o3 | |
5 куб. см. | 0,1 куб. см. | 100 куб. см. | 0,1 куб. см. | Осадка нет. |
5 ««. | 0,5 ««. | 100 ««. | 0,2 ««. | |
5 ««. | 1,0 ««. | 100 ««. | 0,3 ««. | |
10 ««. | 0,1 ««. | 100 ««. | 0,4 ««. | |
10 ««. | 0,5 ««. | —. | —. | |
10 ««. | 1,0 ««. | —. | —. |
Серная к-та | Золь гидрата А12о3 | Серная к-та | Золь гидрата А1203 | |
100 куб. см. | 0,5 куб. см. | 50 куб. см. | 3,0 куб. см. | Получается осадок. |
100 ««. | 0,6 ««. | 50 ««. | 4,0 ««. | |
50 ««. | 1,0 ««. | 25 ««. | 1,0 ««. | |
50 ««. | 2,0 ««. | 25 ««. | 5,0 ««. | |
25 ««. | 6,0 ««. | 25 ««. | 10,0 ««. | Осадка нет. |
Получающиеся здесь соотношения весовых количеств А1203 и S03, колеблются от 1 А1203: 10,78 S03 до 1 А1203 :0,27 S03.
Опыт с фосфорной кислотой (0,8 498 Р205 и 0,295 А12Ов в 1 куб. см) дал соотношения от 1 А1203: 0,58 Р205 до 1 А1203:1,44 Р208.
Опыт с осаждением раствором двууглекислого кальция (0,412 г СаО и 0,415 г А1208 в 1 куб. см) обнаружил, что осаждение начинается с отношения 1 А1203 :0,25 СаО и продолжается при увеличении концентрации раствора Са (НС03)2, при чем границы этой концентрации, прекращающей осаждение, не достигнуто.
[Коагуляцию почвенных коллоидов и глинистых суспензий под влиянием электролитов в новейшее время весьма тщательно изучали Gallay, Wiegner, Tuorila, Mattson и ряд других исследователей. Gallay при изучении явлений коагуляции пользовался той фракцией почвенной суспензии, которая не осаждалась в течение 24 часов. После 30-секундного воздействия определенной концентрации электролита производилось по 300 отсчетов количества взвешенных частичек суспензии в ультрамикроскопе, и из этих отсчетов выводилось среднее значение для каждого определения. Кроме этого, характеристика коагуляции производилась на основании измерений вязкости, при чем принималось, что между вязкостью и общим объемом взвешенных частичек существует в очень слабых концентрациях и в очень узких пределах линейная зависимость. Интереснее всего в этой работе то что в ней впервые было обращено внимание на влияние состава поглощенных оснований, имеющихся уже в почве. Для изучения этого влияния были приготовлены, предварительным насыщением соответствующими хлоридами и последующим отмыванием Избытка соли, почва, насыщенная Са, почва, насыщенная К, почва, насыщенная Na, и почва, насыщенная NH4. При коагуляции этих почв под влиянием. 0.0001; 0,001; 0,01; 0,1 и 1 н. раствора СаС12 и КС1 обнаружены следующие закономерности; 1) по сравнению с Naи К-почвой, большую чувствительность показала ИН4-почва; наибольшую же чувствительность из числа исследованных почвенных суспензий обнаружила Са-почва; таким образом, и здесь перед нами та же закономерность, которая существует в явлениях адсорбции, т. е. почвы, по своей чувствительности к коагуляции, располагаются, согласно лиотропному ряду насыщающих их катионов (Са, NH4, К, Na);
2) коагулятор-электролит СаС12 действует сильнее, чем КС1, независимо от того, к какой почвенной суспензии они оба применены; 3) СаС12 коагулирует быстрее Са-почву, чем почвы с одновалентными катионами.
Из этих данных ясно вытекает, что явления коагуляции коллоидов и суспензий не могут быть изучаемы вне связи с теми катионами, которые первоначально уже имелись в изучаемой суспензии.
4) Измерения вязкости Саи К-почвенной суспензии при коагуляции ее одинаковыми концентрациями хлоридов Cs, Kb, К, NH4, Na, Li, Mg, Са и Ba подтвердили различное коагулирующее действие катионов, при чем последние располагаются в этом отношении в лиотропный ряд: Ва > Са > Mg > Cs > Rb > К > NH4 > Na > Li.
Tuorila проследил в своей обширной работе зависимость между коагуляцией и электрокинетическим потенциалом, гидратацией ионов и химическими явлениями, происходящими между коллоидом и коагулятором. Изложенные выше представления о первом и втором критическом потенциале, а также предварительные исследования Tuorila свидетельствовали о тесной связи между электрокинетическим явлениями и коагуляцией. Объектами своего исследования Tuorila избрал: суспензии глины, кварца и натриевого пермутита, Подобно Gallay’io, Tuorila изучал коагуляцию при помощи подсчета частичек в ультрамикроскопе в специальной камере собственной модификации и одновременно измерял скорость катафореза частичек, применяя в качестве коагуляторов электролиты в различной концентрации (от 0 до 20 миллимолей). Для глинистой суспензии Tuorila получил следующий ряд. как по возрастанию коагулирующего действия, так и по уменьшению величины электрокинетического потенциала для одинаковых концентраций электролитов (20 миллимолей):
Величина заряда в момент коагуляции в милли-вольтах. | |
LiCl. | — 37,5. |
NaCl. | — 37,4. |
КС1. | — 21,4. |
CsCl. | — 16,2. |
AgN03 | — 18,2. |
HC1. | — 9,0. |
Таким образом Tuorila обнаружил полный параллелизм между коагуляцией и понижением электрокинетического потенциала в присутствии перечисленных солей. Аналогичный ряд получил Tuorila и для хлоридов Mg, Са, Sr и Ва в концентрации 0,007 и при их коагуляции глинистой суспензии. Им получены следующие данные:
Величина заряда в момент коагуляции в милли-вольтах. | |
MgCl2 | — 25,5. |
СаС12 | — 18,2. |
SrCl2 | — 17,3. |
ВаС12 | — 17,2. |
Здесь опять-таки наблюдается, следовательно, подтверждение лиотропного ряда: Ва понижает заряд сильнее Sr, Sr — сильнее Са, Са — сильнее Mg. Однако, в зависимости от реакции среды этот ряд может быть нарушен. Так в опытах с щелочным (pH = 8,3) натриевым пермутитом Tuorila получил полное перевертывание ряда, т. е. оказалось, по коагулирующему действию, Ва < Sr < Са < Mg, что объясняется следующим обстоятельством: благодаря щелочной реакции, при малых концентрациях хлоридов, образуются гидроокиси Mg, Са, Sr и Ва, из которых наименьшей растворимостью обладает Mg (ОН)2; благодаря этому, в последнем случае происходит наибольшее связывание ОН-ионов, а отсюда и большее падение pH, чем в остальных случаях, тем самым большее падение электрокинетического потенциала и, кроме того, более сильный коагуляционный эффект под влиянием уже выпадающих гидроокисей. Эти отступления в зависимости от pH проверялись Tuorila очень тщательно для большого числа электролитов в присутствии различных концентраций NaOH. При MgCl2, СаС12, ВаС12 и др. в отсутствии NaOH глинистая суспензия коагулировала, согласно следующему ряду катионов:

в присутствии 0,25 миллимолей NaOH те же катионы при коагуляции той же глинистой суспензии дали следующий эффект:
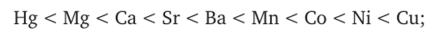
при 0,5 миллимолях NaOH:
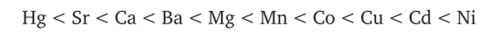
и при 1 миллимоле NaOH:
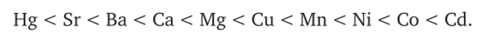
Интересные исследования по коагуляции почвенных коллоидов иод влиянием электролитов в связи с электрокинетическим потенциалом производил S. Mattson. В своих экспериментах Mattson пользовался следующим методом: 25 куб. см суспензии из почвенных коллоидов смешивалась с 25 куб. см раствора электролита различной концентрации, и эффект коагуляции наблюдался на следующий день; после этого система встряхивалась, и наблюдался катафорез частичек в приборе Mattson’a. Изучено коагулирующее действие растворов солей натрия с анионами различной валентности, КС1, СаС12, Са (ОН)2 А1С13, NaOH, NaOH + СаС12, NaOH + Са (ОН)2 метиленблау, Na4FeCy6 + СаС12, Na4FeCye + метиленблау, HCl, H2S04, Н3Р04, NaCl и КС1 (в алкоголе) на различные почвенные коллоиды. Многообразные весьма интересные данные работы Mattson’a получены, подобно Gallay’io, для почвенных коллоидовк насыщенных различными катионами, именно для электродиализированных (Н-насыщенных), насыщенных натрием, калием, кальцием Sharkeyи Norfolk-почвенных коллоидов. В отличие от Gallay’B, Mattson, подобно Tuorila, измерял электрокинетический потенциал коагулирующих частичек. Таким образом Mattson синтезировал методы и Gallay’B и Tuorila. Исследования Mattson’a привели к следующим результатам:
- 1) коагуляция почвенных коллоидов происходит до наступления полной нейтрализации заряда, понижение величины которого идет и после коагуляции;
- 2) величина критического потенциала зависит не только от концентрации электролита-коагулятора, но и от природы того катиона, которым была предварительно насыщена почва. Насыщенный водородным ионом (электродиализированный) коллоид оказался наиболее чувствительным к электролитам, что можно объяснить тем, что при наличии обменной кислотности происходит мобилизация и трехвалентных катионов (А1 и Fe), которые действуют совместного введенным электролитом-коагулятором;
- 3) нет строгого параллелизма между величиной потенциала и устойчивостью почвенных коллоидов. Каждая пара ионов имеет свой критический потенциал для коагуляции почвенного коллоида, как это мы видели и из работы Tuorila; при чем для электродиализированного Sharkey-почвенного коллоида (1,4 г в 1 литре) имеем следующий ряд электролитов по понижению критического потенциала: NaOH (-64,7 mV), КС1 (-50,5 mV), Ca (OH)2 (-19,9 mV), СаС12 (-18,7 mV);
- 4) в присутствии щелочи наблюдается, как и в опытах Tuorila, нарушение ряда Ва > Sr > Са > Mg. В отличие от Tuorila, Mattson объясняет это адсорбированием на внутренней обкладке глинистых частичек гидроксильных ионов, что в свою очередь должно вести к изменению величины адсорбции (емкости поглощения) двухвалентных катионов. Однако, из всех имеющихся данных вытекает, что представление Tuorila об образовании гидроокисей разной степени растворимости, повидимому, более приемлемо, как по простоте объяснения, так и по своему соответствию наблюдаемым явлением. Точка зрения Tuorila является, в сущности, развитием взгляда Wiegner’a на образование поглощенными катионами гидроокисей на поверхности коллоидной частички и имеющими в связи с разной степенью растворимости гидроокисей различные константы вхождения и выхода.
Здесь трудно детализировать вопрос о коагуляции почвенных коллоидов далее. Мы опускаем из-за недостатка места изложение многих весьма существенных сторон этого вопроса, например: новые сведения о влиянии одноименных с коллоидом ионов электролита на коагуляцию коллоида, о значении валентности аниона электролита при коагуляции отрицательно-заряженной почвенной суспензии (Mattson), о роли водородного иона при коагуляции нейтральной солью, о коагуляции под влиянием смеси электролитов, о явлениях так называемой десорбции после выпадения коллоида, наконец, о так называемой механической коагуляции, отсылая читателя к последним сводкам литературы по почвенным коллоидам].
- [1] Позже Аттерберг нашел более удобным взять вместо 0,2, 0,02 и 0,002 — величины0,3, 0,03 и 0,003.
- [2] Субмикроны видимы еще в ультрамикроскопе как отдельные частички.
- [3] Freundlich, Н. Kapillarchemie. 1923.
- [4] Bechhold. Zeitschr. f. physik. Chemie. Bd. 48, 1904. «Die Kolloide in Biologie und Medizin. 1912.
- [5] Friedemann, H. Archiv f. Hygiene. Bd. 55.1906; Zeitschr. f. exper. Pathologie, Bd. 3,1906.
- [6] Buxton В. H. u Schoffer P. Zeitschr. f. physik. Chemie, 1906. «» Teague O. Ibidem; см. работы тех же авторов в Zeitschr. f. phys. Chemie, 1907. «» Kolloid-Zeitschr, Bd. II, 1908.
- [7] Wityn, J. Mitteilungen derlnternat Bodenkundl. Geselsch. Neue Folge, Bd. II, № 1,1926.
- [8] Aarnio B. Suomen geologinen toimisto. Geoteknillisia Tiedonantoja, № 16, Helsinki, 1915.