Метод молекулярных орбиталей

Если электронные волны первого и второго атомов водорода совпадают по фазе, то их амплитуды складываются и волны усиливают друг друга. В этом случае говорят о положительном перекрывании атомных орбиталей и образо; Показано основное состояние, при котором два электрона заселяют связывающую МО, а разрыхляющая МО вакантна связи соответствует удвоенной разности энергий атомной орбитали 1 s… Читать ещё >
Метод молекулярных орбиталей (реферат, курсовая, диплом, контрольная)
Идея метода заключается в том, в молекулярных системах, как и в атомах, должны существовать определенные орбитали, которые можно назвать молекулярными. Им соответствуют решения уравнения Шредингера для молекул. С точки зрения квантовой механики мы, исходя из орбиталей отдельных не взаимодействующих друг с другом атомов, учитываем далее взаимодействие всех ядер и электронов, составляющих молекулу, и находим одноэлектронные волновые функции — молекулярные орбитали (МО) — результирующей молекулы.
Молекула Н2 с точки зрения метода МО.
При сближении двух атомов водорода их 15-орбитали начинают проникать друг в друга — перекрываться. Приближенная картина взаимодействия двух электронов при этом и форма образующихся молекулярных орбиталей показаны на рис. 3.3.
Если электронные волны первого и второго атомов водорода совпадают по фазе, то их амплитуды складываются и волны усиливают друг друга. В этом случае говорят о положительном перекрывании атомных орбиталей и образо;
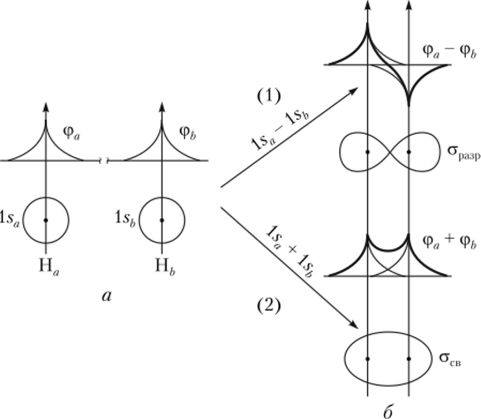
Рис. 3.3. Образование молекулярных орбиталей Н9:
a — отдельные атомы: ls-орбитали первого и второго атомов водорода не перекрываются; б — атомы сближены: ls-орбитали отдельных атомов водорода перекрываются; 1 — электронные волны первого и второго атомов водорода находятся в противофазе и ослабляют друг друга в области перекрывания, образуется разрыхляющая молекулярная орбиталь (а); 2 — электронные волны первого и второго атомов водорода совпадают по фазе и усиливают друг друга в области перекрывания, образуется связывающая молекулярная орбиталь (стсв).
вании связывающей молекулярной орбитали. Результирующая молекулярная орбиталь может быть записана в виде суммы МОсв = АО (1 $д) + АО (1 sh)[1].
Сам факт образования химической связи говорит о том, что уровень связывающей МО лежит ниже по энергии, чем исходные уровни l. v-AO в изолированных атомах (рис. 3.4).
В соответствии с принципом минимума энергии в молекуле водорода в основном состоянии связывающая МО заселена двумя электронами. При этом принцип Паули требует, чтобы эти электроны имели противоположные спины. Тогда молекула не имеет постоянного магнитного момента, что подтверждается экспериментально. Если пренебречь межъядерным и межъэлектронным отталкиванием в молекуле, то очевидно, что энергия.
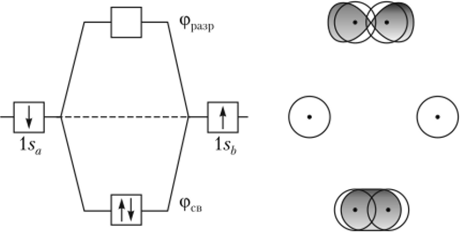
Рис. 3.4. Энергия молекулярных орбиталей молекулы Н2.
Показано основное состояние, при котором два электрона заселяют связывающую МО, а разрыхляющая МО вакантна связи соответствует удвоенной разности энергий атомной орбитали 1 s и молекулярной орбитали МОсв.
Если же электронные волны находятся в противофазе, то они взаимно уничтожаются, в межъядерной области происходит их интереференционное ослабление. Соответствующую разрыхляющую молекулярную орбиталь можно записать в виде разности МОра;ф = AO (lse) — АО (1 sh). Ее энергия лежит выше энергии ls-AO настолько же, насколько ниже него находится связывающая МО. В молекуле водорода в основном состоянии разрыхляющая МО вакантна.
В принципе, на двух МО, изображенных на рис. 3.4, может находиться от нуля до четырех электронов. Если электронов нет, то два протона будут просто отталкиваться друг от друга, и, действительно ион Н2+ не существует. Один электрон на МОсв соответствует молекулярному иону Н2, два — молекуле Н2. Принцип Паули требует, чтобы третий электрон в ионе Н2 и четвертый в Н2" размещались на МОра;ф. В методе МО в качестве формальной меры прочности связей используется разность между числом электронных пар на связывающих и разрыхляющих МО, приходящаяся на одну связь. Эта величина, называемая формальным порядком связи, в ряду Н2+, Н2, Н2, Н2 и Н2 равна 0,½, 1,½ и 0, соответственно, а экспериментальные энергии связей для частиц Н2, Н2, Н2 составляют 265, 436 и 17 кДж/моль; ион НН2 не существует. Если учесть, что в рассмотренном ряду растет межэлектронное отталкивание, то описание нашего ряда с помощью метода МО надо признать вполне успешным.
- [1] С точностью до масштабного множителя, которым мы здесь и в дальнейшем пренебрегаем.