Ферменты, коферменты и кофакторы

Механизм действия ферментов до конца не раскрыт. Наиболее общим представлением является система «замок — ключ» (фермент — субстрат), выдвинутая Э. Фишером в 1894 г. и развитая Дж. Холдейном в 1930 г. Согласно этой теории, молекула субстрата точно соответствует по своей форме некоторому участку на молекуле фермента. Причем при связывании субстрата с ферментом его связи, подлежащие изменению… Читать ещё >
Ферменты, коферменты и кофакторы (реферат, курсовая, диплом, контрольная)
Жизнь при всем ее многообразии характеризуется довольно однотипными химическими изменениями, скоординированными во времени и пространстве, в результате которых пища превращается в энергию и структурные материалы, необходимые организму для роста и воспроизведения; при этом токсичные отходы и шлаки удаляются. Многие из этих химических изменений невероятно сложны с точки зрения органической химии и не могут быть сегодня воспроизведены в лабораториях даже с помощью всего имеющегося мощного арсенала разнообразных средств. Вдобавок к этому следует сказать, что в живых организмах все эти реакции реализуются в очень мягких условиях (около 37 °C и при pH, близких к нейтральному). Такого рода процессы нельзя себе представить без участия катализаторов, причем на несколько порядков более мощных, чем используемые сегодня химиками-органиками в нормальных каталитических процессах.
Такими катализаторами, создаваемыми живыми системами, являются ферменты (энзимы). К настоящему времени идентифицировано более 1000 ферментов, и этот список быстро пополняется. Существует строгая система классификации ферментов (она обычно приводится в курсах биохимии), но ферменты имеют и тривиальные названия. Они составляются путем прибавления окончания —аза к слову (или его части), обозначающему вещество, на которое данный фермент действует. Исключение составляют пищеварительные ферменты, для которых укоренились названия, оканчивающиеся на —ин. — пепсин, трипсин, папаин и т. п.
Вещество, на которое действует фермент, называется субстратом. Так, фермент, гидролизующий жиры или липиды, называется липазой, действующий на обычный сахар — Саха ра. юй и т. д. Однако на каждый субстрат могут действовать, и по-разному, несколько ферментов. Так, молочная кислота ферментативно может превращаться в иировиноградную (это процесс, в результате которого молочная кислота теряет два атома водорода), поэтому фермент называется лактатдегидрогена зой. Другой фермент окисляет молочную кислоту с образованием уксусной кислоты, С02 и Н202; этот фермент называется лактатоксидазой. Ферментативные процессы сегодня очень широко применяются в биотехнологии, медицине, фармакологии, ботанике, земледелии, генетике, микробиологии. Некоторые производства: виноделие, пивоварение, по существу, являются отраслями промышленной энзимологии. Итак, катализ биохимических реакций, протекающих в живых организмах, осуществляется ферментами. Ферменты могут иметь и чисто белковую структуру (рибонуклеаза, уреаза; пищеварительные ферменты: трипсин, пепсин, папаин и др.). Однако в большинстве случаев они являются протеидами, т. е. состоят из белковой части — апофермента (обычно не обладающего ферментативной активностью) и небелковой группы неорганической или органической природы. Если такого рода группа, называемая кофактором, связана с апоферментом непрочно, так, например, ее можно отделить диализом и она в ходе катализа мигрирует от одного апофермента к другому, то она называется коферментом. Прочно связанный с апоферментом кофактор называется простетической группой. В роли неорганических кофакторов, как правило, выступают ионы металлов: Na+, К Rb+, Mg2+, Са2+, Zn2+, Cu2+, Fe2+, NH^ и др. Одни коферменты способствуют переносу электронов, атомов водорода, химических группировок. Другие, подобно АТФ, обеспечивают биохимические процессы энергией. Некоторые коферменты относятся к группе витаминов, т. е. не могут синтезироваться в животном организме и должны поступать вместе с пищей.
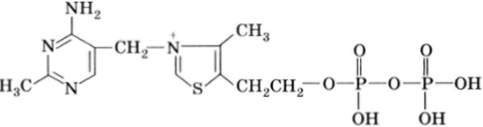
Так, аденозинмонофосфат (АМФ), поглощая энергию, образующуюся при окислении углеводов, может присоединять еще один или два остатка фосфорной кислоты, образуя при этом аденозиндифосфат (АДФ) и аденозинтрифосфат (АТФ):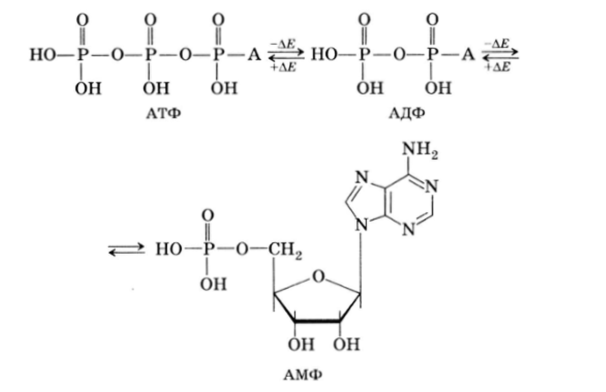
АДФ и особенно АТФ содержат богатые энергией фосфатные связи. Поэтому при переносе остатка фосфорной кислоты молекулой АТФ на какой-то биологический акцептор (R—Н) выделяется значительное количество энергии (трансфосфолирование), происходящее под действием киназ:
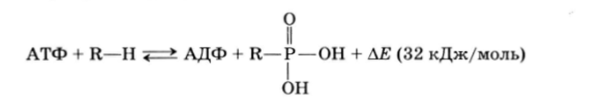
Подавляющее число реакций, протекающих в живых организмах с потреблением энергии, получают ее за счет расщепления АТФ: это главным образом активация кислот, аминокислот, желчных и неорганических кислот. Свободную энергию, накопленную АТФ, организм может использовать не только в биохимических синтезах, но и, например, в качестве механической энергии мышц, электрической энергии специальных органов (электрический угорь) или лучистой энергии (излучающий орган светлячков).
Многие окислительно-восстановительные реакции в живых организмах осуществляются с участием кофакторов, содержащих амид никотиновой кислоты. Молекула никотинамидадениндинуклеотида (НАД) представляет собой внутреннюю соль состава (R=H):

Перенос водорода от биологического донора водорода (ВН2) к НАД осуществляется согласно следующей схеме:
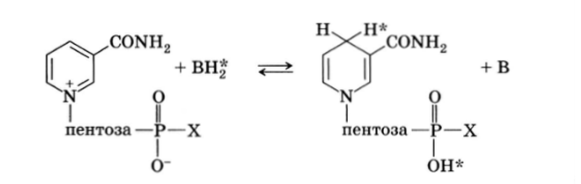
Близким по типу действия кофактором является НАДФ (на схеме выше R=P03H2).
С участием НАД происходит окисление спиртов в альдегиды, например ретинола в ретиналь. Восстановленный НАД • Н запасет энергию и гидридный водород, выделенные, например, при окислении спирта, и сможет расходовать их в других биохимических процессах, требующих затраты энергии, например, при восстановительном аминировании кетокислот в аминокислоты. При этом НАД регенерируется.
Ниже приведены еще несколько простейших коферментов и кофакторов. Кофактором ферментов в ряде обратимых реакций карбоксилирования является биотин:
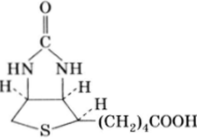
Он играет важную роль в обмене углеводов, липидов, белков, НК. В качестве простетических групп ферментов декарбоксилирования выступает тиаминпирофосфат:
Механизм действия ферментов до конца не раскрыт. Наиболее общим представлением является система «замок — ключ» (фермент — субстрат), выдвинутая Э. Фишером в 1894 г. и развитая Дж. Холдейном в 1930 г. Согласно этой теории, молекула субстрата точно соответствует по своей форме некоторому участку на молекуле фермента. Причем при связывании субстрата с ферментом его связи, подлежащие изменению, несколько растягиваются, что облегчает их последующий разрыв. Многие ферменты строго специфичны: уреаза — катализирует только гидролиз мочевины; аргиназа — гидролизует только L-аргинин до L-орнитина и мочевины.
Специфичность ферментов так высока, что они различают идентичные группы даже в прохиральных молекулах. Так, фермент глицерокиназа переносит фосфатную группу с АТФ на глицерин, образуя хиральный а-глицерофосфат.
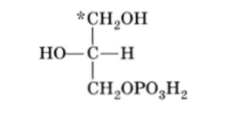
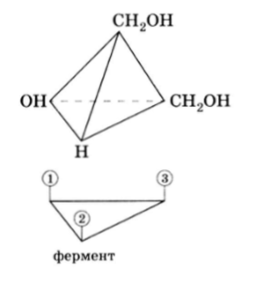
Так вот, если в прохиральном глицерине верхнюю группу (в приведенной формуле Фишера) пометить (*С, например, 14С или 13С), то в реакции принимает участие всегда нижняя группа. Изобразив пространственную структуру глицерина и фрагмент участка фермента, в котором точка 3 соответствует прикреплению группы СН2ОН, точка 2 — группы Н и точка 1 — группы ОН, мы видим, что существует только один-единственный способ связывания, и следовательно, реакционноспособной является всегда одна и та же группа — СН2ОН (в данной формуле нижняя):
- [1] Более подробно с этим разделом можно ознакомиться в кн.: Малер Г., Кордес Ю. Основы биологической химии. — М.: Мир, 1970; ОвчинниковЮ. А. Биоорган и ческа я химия. — М.: Просвещение, 1987.