Двух-и многоатомные спирты

Из трехатомных спиртов особое место занимает глицерин ОН— СН—СН —СН—ОН, входящий в состав организмов животных в виде ОН жиров (или липидов). Это биогенное соединение широко применяют в лабораторной практике и различных отраслях промышленности. Глицерин получен впервые шведским химиком К. В. Шееле в 1779 г. из жира. Глицерин — густая, гигроскопическая жидкость, сладкая на вкус, не имеющая запаха… Читать ещё >
Двух-и многоатомные спирты (реферат, курсовая, диплом, контрольная)
Важнейшими среди двухатомных спиртов (в них два атома кислорода) являются этиленгликоль и а-пропиленгликоль (пропандиол-1,2). Гликоли имеют сладкий вкус (от греч. гликюс — сладкий).

Гликоли — бесцветные, вязкие, сильно структурированные за счет Н-связей жидкости. В отличие от одноатомных спиртов они труднолетучи, поэтому не имеют запаха. При температуре кипения они разлагаются. Гликоли тяжелее воды (р = 1,13 г/см3), тогда как все спирты легче воды. В разделе алкенов отмечалось, что гликоли получаются из них окислительным гидроксилированием при действии КМп04 в щелочной среде или Н202 в муравьиной кислоте:
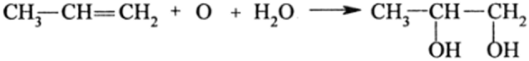
В промышленности широко используется окисление этилена до его окиси с последующей гидратацией: 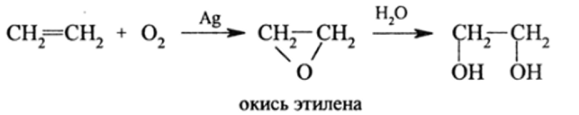
Естественно, гликоли могут быть получены из 1,2-, 1,3-, 1,4-дигалогенопроизводных и т. д., а также восстановлением диальдегидов, дикетонов, кетоальдегидов, кетоспиртов и т. п.
Г ликоли дают все реакции спиртов, с той лишь разницей, что они проходят дважды и притом ступенчато: 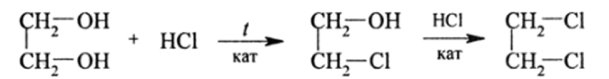
Первая стадия реакции идет легче, чем вторая. Поэтому из гликоля можно получить этиленхлоргидрин НОСН2СН2С1, важный технический продукт, используемый в синтезе красителей (индиго и др.), лекарств (новокаин и др.), отравляющих веществ, а также как растворитель.
Алкоголяты гликолей носят название гликолятов и в отличие от спиртов легко образуются не только со щелочными, но и с многими р— и ^/-металлами, например, Си, Zn, Pd и др. Так, СиО легко растворяется в щелочном растворе гликоля с образованием интенсивно-синих гликолятов меди:
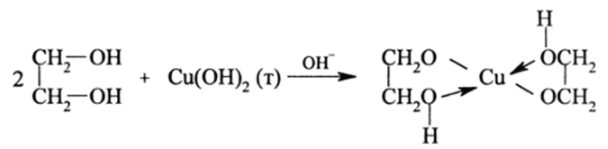
Спирты в такие реакции не вступают из-за более низкой кислотности по сравнению с гликолями (рАГ0 =15 для этиленгликоля). Кроме того, второй гидроксил гликоля, не потерявший свой протон, вступает в комплексообразование с катионами №Г образуя хелатные комплексы, которые более спабильны в растворах, чем обычные комплексы.
Из простых эфиров гликолей важное значение имеет неполный этиловый эфир этиленгликоля — этилцеллозольв HOCH^C^- О—СН2СН3. Он имеет спиртовую и простую эфирные группы и является универсальным растворителем, особенно широко применяемым в практике крашения и отделки текстильных материалов. Технически очень важной реакцией является дегидратация гликолей. Кипячение их с разбавленной H2S04 дает в конечном итоге простые циклические диэфиры:

Диоксан, так же как и диэтиленгликоль, является великолепным растворителем органических соединений. В качестве растворителей при проведении разнообразных химических реакций (синтез, комплексообразование и др.) широко используются водно-диоксановые смеси, так как диоксан смешивается с Н20 во всех отношениях.
Гликоли легко окисляются. Продукты их окисления используются в тонком органическом синтезе:
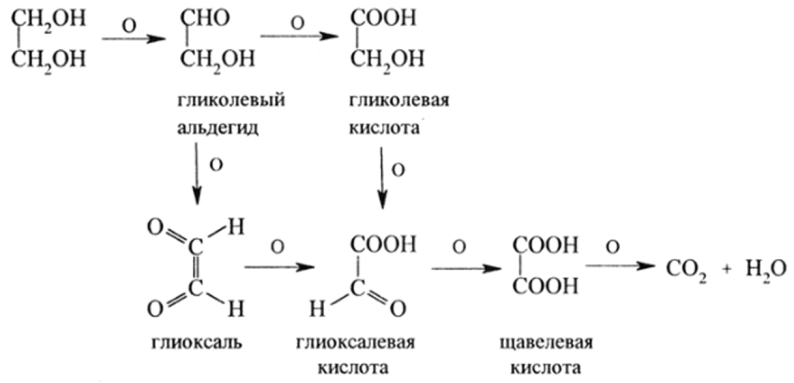
В качестве окислителей в зависимости от необходимости получить тот или иной продукт используются H202, Н2Сг207, HN03 и др.
Этилен гликоль в больших количествах используется как антифриз, для синтеза пластмасс, смол и лаков, синтетических волокон (лавсан), макроциклических полиэфиров (краун-эфиров) и др.
Из трехатомных спиртов особое место занимает глицерин ОН— СН—СН —СН—ОН, входящий в состав организмов животных в виде ОН жиров (или липидов). Это биогенное соединение широко применяют в лабораторной практике и различных отраслях промышленности. Глицерин получен впервые шведским химиком К. В. Шееле в 1779 г. из жира. Глицерин — густая, гигроскопическая жидкость, сладкая на вкус, не имеющая запаха. Имеет = 18 °C и /кип = 290 °C. Разлагается при температуре кипения. Чрезвычайно сильно структурирован, так как его молекулы еще сильнее, чем молекулы гликолей, «сшиты» межмолекулярными водородными связями в подвижную трехмерную сетку. Поскольку время жизни водородной связи.
I.
— ОН • • • О-Н невелико и определяется скоростями обмена протонов (тж ^ КГ13 с), то в результате такого взаимодействия образуется жидкое, а не твердое состояние, если температура стандартная. В Н20 сетка Н-связей частично разрушается и в Н-связь со спиртовыми группами вступают молекулы Н20, поэтому глицерин смешивается с водой во всех соотношениях.
Важнейшим свойством глицерина является его способность образовывать с карбоновыми кислотами полные сложные эфиры, которые отличаются друг от друга природой кислотного остатка и их взаимным расположением в молекуле жира:
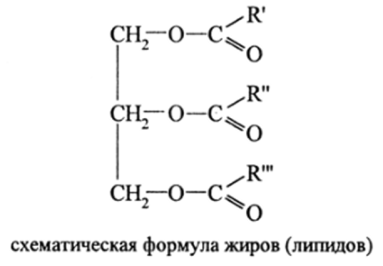
Жиры входят в состав клеточных мембран организма, защищающих клетку от внешних воздействий, и накапливаются в виде свободных отложений.
В качестве кислот в зависимости от вида жиров выступают предельные одноосновные кислоты — стеариновая С17Нз5СООН, пальмитиновая Ci5H3|COOH, масляная С3Н7СООН и др. с четным числом атомов углерода. Так, жир быка содержит триглицериды (т. е. полные сложные эфиры) стеариновой кислоты; жир барана, человека (а также кокосовое масло) содержат триглицериды пальмитиновой кислоты; в сливочном масле вместе с этими триглицеридами имеется много глицеридов масляной кислоты и ее гомологов от С6 до С14.
В отличие от твердых жиров в жидких маслах содержатся непредельные кислоты, содержащие одну (олеиновая кислота С17Н33СООН), две (линолевая кислота С|7Н3|СООН), три (линоленовая кислота Ci7H2QCOOH), четыре (арахидиновая кислота Ct7H27COOH) двойных связи, всего 40 разных кислот С18—С2о с разным числом и положением двойных связей. Они содержатся в подсолнечном, льняном, конопляном, ореховом и других «высыхающих» маслах. Высоконепредельные жидкие жиры совершенно необходимы, как и витамины, для жизнедеятельности человека. Они не синтезируются в организмах животных и должны поступать с растительной пищей.
Жиры выполняют в организме функцию источника энергии и «строительного» материала клеток. Кроме жиров, в состав клеточных мембран входят смешанные эфиры карбоновых и ортофосфорной кислот, так называемые фосфатиды. В этих триглицеридах один гидроксил этерифицирован фосфорной кислотой. Второй гидроксил этой кислоты образует сложноэфирную группировку с аминоспиртами — этанол амином НОСН,—CH2NH2 или с.
его триметиламмониевой солью (холином) OHCH., CH2N (CH3)3 .Таким образом построены два важнейших фосфатида — кефалин (мозговых клеток) и лецитин (в клетках яйца, печени, соевых бобах):
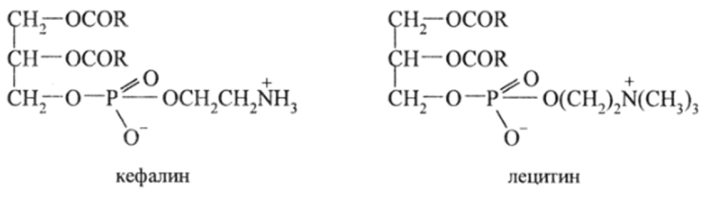
Жидкие жиры находят техническое применение для изготовления олифы, масляных красок, маргарина и т. д.
До настоящего времени глицерин вместе с жирными кислотами получается гидролизом жиров с помощью перегретого пара или иным способом:

Однако потребности в глицерине столь велики, что большая часть его получается синтетическими способами. Главным полупродуктом синтеза является хлористый аллил, на который действуют хлором и водой: 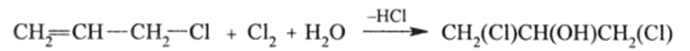
Последующее действие водной Са (ОН)2 лает глицерин:
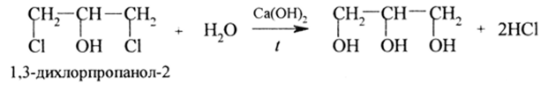
Имеется несколько других технических способов синтеза, в том числе из пропилена, формальдегида и уксусного альдегида, глюкозы.
Важнейшими реакциями глицерина являются: образование сложных эфиров с карбоновыми кислотами (искусственные жиры), с азотной кислотой (тринитроглицерин), глицератов с гидроксидами щелочных, щелочноземельных и большинства (/-металлов (исключая Cd и Hg). Образование сложных эфиров катализируют кислоты. Механизм тот же, что и у спиртов. Так, с HN03 в присутствии H2S04 глицерин образует тринитрат:
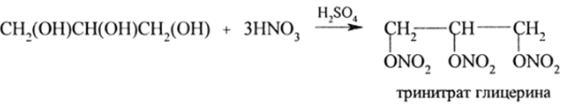
Нитроглицерин — это почти бесцветная маслянистая жидкость, которая при нагревании или ударе взрывается со страшной силой. В 1867 г. А. Нобель обнаружил, что при пропитке нитроглицерином кизельгура исчезает способность взрываться от удара или нагревания. Получается так называемый динамит, который взрывается при детонации. В настоящее время кизельгур заменяют нитроцеллюлозой («коллоксилин») и опилками. При изготовлении пластиковой взрывчатки используют смесь пироксилина (нитроцеллюлоза) и нитроглицерина, а бездымный порох готовится из нитроглицерина, пироксилина и вазелина.
Глицераты цветных и тяжелых металлов образуются в щелочной среде в виде хелатных комплексов. Их образование может быть использовано для предотвращения выпадения их гидроксидов в щелочной среде. Глицерат меди, имеющий ярко-синий цвет, используется в аналитических целях для обнаружения глицерина:
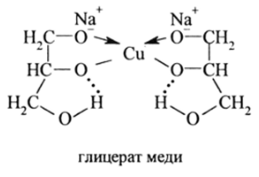
Глицерин — более сильная кислота, чем гликоль. Для него р= 14. Поэтому в щелочном растворе NaOH глицерин однократно ионизирует. Ионизация второго гидроксила происходит под действием электростатического поля иона Си2+. Третий гидроксил остается не ионизированным и образует с хелатирующим кислородом внутримолекулярную водородную связь. Все это создает большой энергетический выигрыш при образовании глицератов М2 М3* и М4
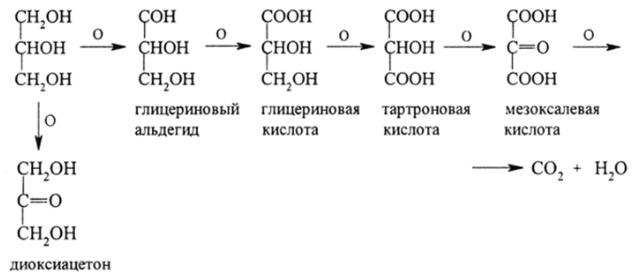
Большой интерес имеют продукты окисления глицерина. Многие из них (глицериновый альдегид, диоксиацетон, глицериновая кислота и др.) играют большую роль в биохимии фотосинтеза, обмена веществ, в тонком органическом синтезе. Окислители Н202, HN03, НВЮ и др. приводят к целому ряду ступеней окисления:
Глицерин находит также широкое применение в ликеро-водочной, пищевой и фармацевтической промышленности, в производстве глифталевых смол — сложных эфиров глицерина с фталевой кислотой С6Н4(СООН)2 и др.