Пероксиды и супероксиды

Положительные степени окисления +1 и +2 кислород проявляет только при взаимодействии с фтором и фторидами. При пропускании фтора через разбавленный раствор щелочи образуется дифторид кислорода: Гексафторплатинат (У) диоксигенила — солеподобное вещество красного цвета с температурой плавления 219 °C. Аналогичные соединения типа 02RF6 получены и с другими элементами. Поэтому реально существуют… Читать ещё >
Пероксиды и супероксиды (реферат, курсовая, диплом, контрольная)
Пероксиды содержат группировку —О—О—, например в пероксосерной кислоте или пероксодисульфат-ионе:
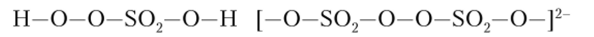
В пероксидах металлов она существует в виде иона 02": Na202, Ва02, Zn02. Наиболее важным представителем пероксидов является пероксид водорода Н—О—О—Н. В чистом виде Н202 — неустойчивая жидкость, постепенно разлагающаяся на воду и кислород. Обычно используют ее водные растворы: 30%-ный раствор — пергидроль, или 3—5%-ный, известный как раствор перекиси водорода.
Кислород в пероксиде находится в состоянии окисления -1 и, как это очевидно из восстановительных потенциалов (см. параграф 16.4):
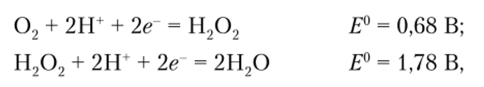
для пероксида водорода в водных растворах возможны три случая окислительно-восстановительных превращений:

Диспропорционирование пероксида водорода.
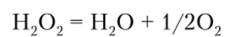
при комнатной температуре идет, но некоторые твердые оксиды (Мп02, РЬ02), платина и ионы тяжелых металлов активно катализируют его. Так же действует освещение. Поэтому растворы пероксида водорода хранят в темноте и на холоде.
При действии восстановителей пероксидный кислород восстанавливается до степени окисления -2:
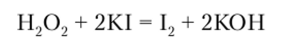
а сильные окислители окисляют его до свободного кислорода: 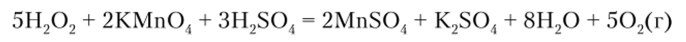 Аналогичные реакции характерны
Аналогичные реакции характерны 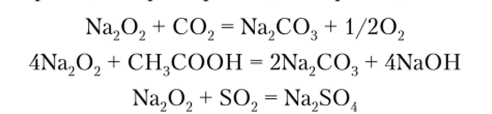 и для пероксидов металлов:
и для пероксидов металлов:
Молекула 02 может присоединить электрон и перейти в супероксидный ион 02. При действии сильных положительных полей, которые создают небольшие многозарядные катионы, ион 02 легко поляризуется и диспропорционирует: 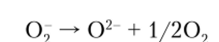
Поэтому реально существуют супероксиды только с большими однозарядными катионами: К02, Rb02 и CsO?. При взаимодействии с водой супероксидный ион моментально разлагается:
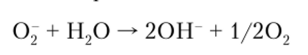
Все супероксиды — очень сильные окислители.
Соединения кислорода в положительных степенях окисления
Положительные степени окисления +1 и +2 кислород проявляет только при взаимодействии с фтором и фторидами. При пропускании фтора через разбавленный раствор щелочи образуется дифторид кислорода:
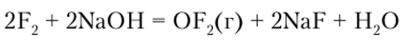
Это ядовитый газ с температурой кипения -145°С, сильный фторирующий агент. Низкая температура кипения свидетельствует о ковалентном характере связи О—Е Соединение 02F2 — диоксодифтор — получается действием электрического разряда на смесь фтора с кислородом при низких температурах. Выше -50°С он быстро разлагается на 02 и F2. По своему строению молекулы OF2 и 02F2 похожи на Н20 и Н202.
Ион 02 — диоксигенил — впервые получен в 1962 г. при реакции кислорода с гексафторидом платины:
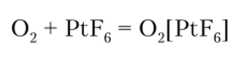
Гексафторплатинат (У) диоксигенила — солеподобное вещество красного цвета с температурой плавления 219 °C. Аналогичные соединения типа 02RF6 получены и с другими элементами.
Рассмотрев свойства кислорода, перейдем теперь к другим типичным электронно-избыточным элементам.
Резюме
За исключением водорода, все неметаллы являются /^-элементами. Они обладают высокой электроотрицательностью и образуют большинство наиболее известных анионов. В земных условиях три p-элемента играют исключительную роль: кислород, углерод и кремний. Именно с кислорода удобно начинать рассмотрение химии р-элементов.
Практикум
Вопросы для самоконтроля
- 1. Как будут взаимодействовать оксиды — типично кислотный (S03), типично основной (СаО) и типично амфотерный (А1203) с водными растворами кислоты (НСЛ) и щелочи (NaOH)? Напишите уравнения соответствующих реакций.
- 2. Как объяснить тот факт, что сухой кислород проявляет активность только при нагревании, а при комнатной температуре практически не реакционноспособен?
Аналитические задания
- 1. Элемент, А является электронно-дефицитным, а элемент В — электронно-избыточным. Обрисуйте в общих чертах химические свойства каждого элемента.
- 2. Перечислите все формы, в которых кислород может существовать в своих соединениях.
- 3. Объясните, почему молекула озона имеет уголковую форму.
Задачи для самостоятельного решения
- 1. Постройте схемы МО для частиц 02, 02 и 02. Предскажите, в какой частице энергия связи наибольшая.
- 2. Найдите соотношение пероксида натрия и супсроксида калия в смеси, которая, поглощая углекислый газ, выделяет равный объем кислорода.
- 3. Определите степень окисления платины в гексафтороплатинате диоксигенила 02[PtF6].