Развитие и функционирование молочной железы при достижении половой зрелости

Поскольку светомикроскопический метод имеет определенные ограничения, представляют существенный интерес сведения об изменении ультраструктуры тканей молочной железы женщины в течение менструального цикла. В литературе имеется достаточно большое количество работ, появившихся главным образом в 1970—1980;е гг., посвященных электронно-микроскопическому исследованию молочной железы женщин. Однако… Читать ещё >
Развитие и функционирование молочной железы при достижении половой зрелости (реферат, курсовая, диплом, контрольная)
Наиболее интенсивное (нормальное) развитие молочной железы начинается с достижением половой зрелости и появлением у девушек менструального цикла. В препубертатный период наряду с повышением концентрации эстрогенов происходит увеличение содержания в крови гонадотропных гормонов — фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) (см. рис. 1.7) (Lee et al., 1976). ФСГ обеспечивает рост и дифференцировку фолликулов в яичнике — фолликулогенез. Фолликулогенез является непрерывным, постоянно продолжающимся процессом до тех пор, пока не истощится запас фолликулов, которые в количестве около 400 тыс. появились в яичнике у пятимесячного плода женского пола. Под влиянием ФСГ в правом или левом яичнике у девушек начинается развитие нескольких фолликулов. Однако через определенное время за исключением одного фолликула происходит остановка роста остальных фолликулов и их деградация — атрезия. Оставшийся фолликул, получивший название доминирующего, секретирует увеличивающиеся количества эстрогена (17(3-эстрадиола). Повышение уровня эстрогена в крови дополнительно стимулирует развитие эндометрия в матке, и в конечном счете эндометрий гипертрофируется. Через определенное время доминирующий фолликул достигает максимального размера, но овуляции, т. е. разрыва стенки фолликула и выхода яйцеклетки, не происходит. Затем фолликул подвергается атрезии, уровень эстрогенов падает, при этом происходит отслоение эндометрия и наступает первое кровотечение, или менархе. Ановуляторные циклы могут наблюдаться у девочек в течение 1—1, 5 лет после менархе. Отсутствие овуляции объясняется тем, что гипофиз не способен освобождать ЛГ в ответ на эстрогены до тех пор, пока не будет максимально активирован гонадотропин-рилизинг-фактор. К моменту менархе эта активация еще не достигает того порога, который необходим для индукции массированного выделения в повышенной концентрации ЛГ (Шорт, 1987).
После наступления менархе в молочной железе количество альвеолярных почек, образованных терминальным протоком, может увеличиваться до 11. Каждый терминальный проток вместе с альвеолярными почками окружен соединительнотканной стромой. Эта структура получила название молочной дольки I типа (Russo, Russo, 2004).
Многочисленные исследования показали, что появление овуляторного менструального цикла сопровождается заметными изменениями в крови женщины концентраций стероидных и гонадотропных гормонов, которые в значительной степени оказывают влияние на развитие молочной железы (рис. 1.9). Здесь следует отметить, что в учебниках и обзорах при графическом представлении динамики концентраций гормонов во время менструального цикла даются сведения только о содержании в крови женщины эстрогена, прогестерона, ФСГ и ЛГ. Вместе с тем с 1980;х гг. существуют достаточно убедительные данные об изменении концентрации пролактина (Guyda, Friesen, 1973; Cole et al., 1977; Vekemans et al., 1977; Хамадьянов и др., 1980; Dada et al., 1981; Backstrom et al., 1982; Braund et al., 1984; Wang et al., 1987; Tanner et al., 2011 и др.) и окситоцина (Mitchell et al., 1981; Amico et al., 1981; Shukovski et al., 1989; Stock et al, 1991; Salonia et al., 2005 и др.) в крови у женщин в течение менструального цикла. Причем уровень концентраций этих гормонов импульсно изменяется в течение цикла в три-четыре раза, т. е. на ту же величину, что и концентрации других гормонов (см. рис. 1.9). Особенностью окситоцина оказалась чрезвычайно низкая концентрация его в крови в сравнении с другими гормонами (см. рис. 1.9). Однако и после родов, во время полноценной лактации, когда окситоцин максимально востребован, его базовая концентрация и изменение во время выведения молока того же порядка, что и не у лактирующих женщин. Это указывает на весьма высокую чувствительность железистой ткани к окситоцину.
Полагают, что у женщин отбор доминирующего фолликула осуществляется в течение первых дней после начала менструации. Так же как при ановуляторном цикле доминирующий фолликул секретирует эстроген (17|3-эстрадиол), отчего уровень его в крови повышается. Когда доминирующий фолликул достигает зрелости, секреция эстрадиола (см. рис. 1.9) достаточна для того, чтобы индуцировать эффект положительной обратной связи, вследствие чего происходит массированное выделение гипофизарного ЛГ с одновременным повышением ФСГ и пролактина. Промежуток времени от начала менструации до момента окончательного созревания доминантного фолликула (примерно 14 дней) получил название фолликулярной фазы (см. рис. 1.9). Следующая фаза получила название овуляторной. Во время овуляторной фазы, которая приходится на середину менструального цикла и длится около трех дней, происходит массированное выделение ЛГ, завершающее развитие фолликула. ЛГ стимулирует продукцию простагландинов и протеолитических ферментов, необходимых для разрыва стенки фолликула и освобождения зрелой яйцеклетки (собственно овуляция). К середине цикла увеличивается концентрация окситоцина (см. рис. 1.9). Овуляция обычно происходит в ближайшие 24 часа после наибольшей волны выброса ЛГ. Время между овуляцией и началом менструального кровотечения называется лютеиновой фазой цикла, которая длится 13—14 дней. После разрыва фолликула его стенки спадают, клетки фолликула накапливают липиды и лютеиновый пигмент придает ему желтоватый цвет. Трансформированный фолликул теперь называют желтым телом. Желтое тело начинает секретировать прогестерон и эстроген. Соответственно, концентрация в крови их повышается. В это же время увеличивается концентрация пролактина. Уровень данных гормонов достигает наивысшего значения в середине лютеиновой фазы, при этом снижается концентрация ФСГ и ЛГ (см. рис. 1.9). К середине лютеиновой фазы, как правило, происходит снижение кон.
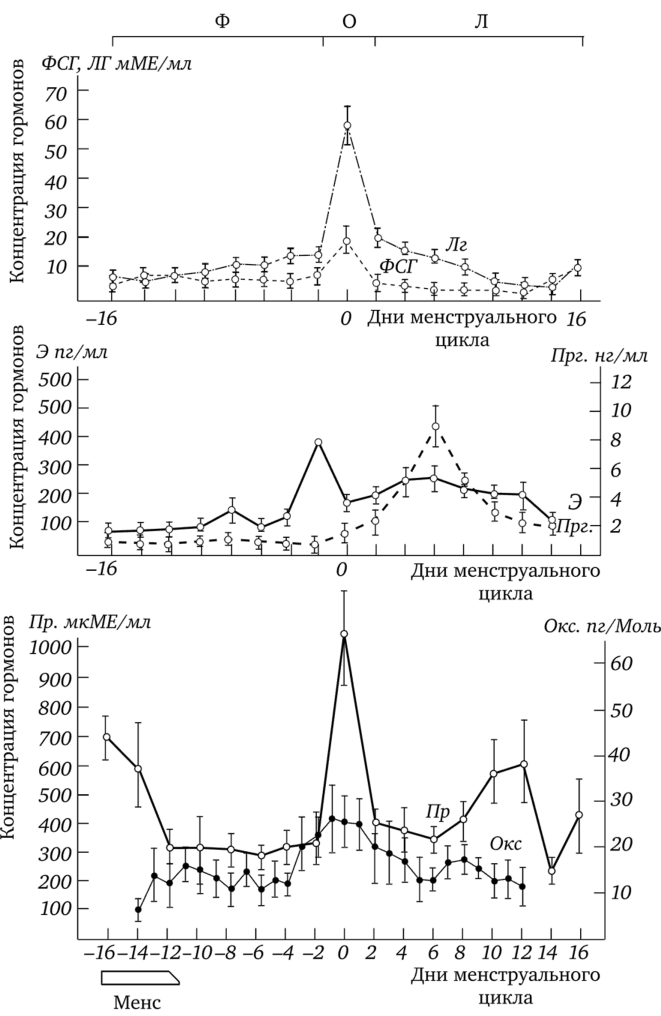
Рис. 1.9. Изменение концентрации пролактина (Пр), фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), эстрадиола (Э), прогестерона (ПРг) (по Хамадьянову и др., 1999) и окситоцина (Ок) (по Shukovski et al., 1989) в сыворотке крови женщин в течении менструального цикла:
Ф — фолликулярная фаза, О — овуляторная фаза, Л — лютеальная фаза;
О — середина менструального цикла; Мене — отметка времени менструации центрации окситоцина (Amico et al., 1981; Shukovski et al., 1989). Вместе с тем есть данные, что у некоторых женщин с нормальным циклом (Stock et al, 1991) содержание окситоцина в крови может, наоборот, повышаться к середине лютеиновой фазы. Особенностью лютеиновой фазы явилось повышение концентрации окситоцина в крови при механической стимуляции соска и ареолы молочной железы. Причем средний пиковый уровень увеличения содержания окситоцина в крови в лютеиновую фазу (Leake et al., 1984b; Amico, Finley, 1986) и в послеродовой период (Leake et al., 1983; Weitzman et al., 1980) имел одинаковую величину.
Увеличенная концентрация эстрогена и прогестерона изменяет свойства двух наружных слоев эндометрия. Железистые клетки эндометрия пролиферируют и начинают секрецию, матка готовится к имплантации оплодотворенной яйцеклетки. Если беременность не происходит, желтое тело прекращает функционировать, уменьшается уровень эстрогенов и прогестерона, что приводит к отечности и некротическим изменением эндометрия. Маточные артерии сужаются, ограничивая питание разросшегося эндометрия. Происходит отторжение наружных слоев эндометрия, которое сопровождается кровотечением. Таким образом, с наступлением овуляторных циклов репродуктивная система женщины каждый месяц приходит в состояние готовности к воспроизводству потомства примерно до 51 года, т. е. до того времени, когда около 99% фолликулов подвергнутся атрезии.
Поскольку молочная железа является составной частью репродуктивной системы, то ее развитие и функционирование также должно изменяться в течение цикла под действием стероидных гормонов, пролактина и окситоцина, которые оказывают влияние на ткани железы через соответствующие клеточные рецепторы, обнаруженные в клетках альвеолярных почек, протоков и стромы. К настоящему времени известны два типа рецепторов к эстрогену — ERa, ER (3; и прогестерону — PRA и PRB; один тип для окситоцина и семь типов рецепторов к пролактину. Рецепторы к стероидным гормонам локализуются в ядрах клеток (Li et al., 2010). Рецепторы для пролактина и окситоцина располагаются в наружной мембране клеток и состоят из трех участковдоменов: экстраклеточного домена, внутримембранного домена и внутриклеточного домена (Freeman et al., 2000; Gill et al., 2001; Gimpl et al., 2008; Clevenger et al., 2009). Динамика концентрации стероидных гормонов, пролактина и окситоцина (см. рис. 1.9) указывает на то, что структурно-функциональные изменения в большей степени, по-видимому, будут происходить в лютеиновую фазу цикла. Детальные морфологические и иммуногистохимические исследования внутренней структуры молочной железы на световом уровне (Vogel et al., 1981; Going et al., 1988; Ramakrishnan et al., 2002; Navarrete et al., 2005) показали, что в начале цикла, в фолликулярную фазу, клетки, образующие протоки, и альвеолярные почки располагаются в два-три слоя и имеют полигональную структуру. При этом трудно различить разницу между клетками, обращенными внутрь полости (люминальные клетки) и располагающимися в базальной области (миоэпителиальные клетки). В альвеолярных почках, имеющих небольшое люминальное пространство, иногда наблюдался продукт секреции, но активной секреции не отмечалось. Доли четко ограничены от слегка отечной интралобулярной стромы клеточным слоем фибробластов. С приближением к овуляторной фазе начинает проявляться разница между люминальными и миоэпителиальными клетками. Люминальные клетки становятся более вытянутыми и располагаются радиально. Цитоплазма их светлая и ядра находятся в базальной части клеток, на апикальной части наблюдаются редкие микровиллы. Миоэпителиальные клетки часто вакуолизированы. В альвеолярных почках и протоках появляются полости, содержащие небольшое количество секрета, с признаками активной секреции люминальных клеток. Дольки четко выделяются среди интерлобулярной стромы, в которой отсутствует отечность. С началом лютеиновой фазы усиливается дифференциация клеток. Дольки увеличиваются в объеме за счет появления дополнительных первичных протоков с альвеолярными почками. Полости в альвеолярных почках и протоках расширяются. Появляются клетки, в которых наблюдается митоз и апоптоз. К концу лютеиновой фазы (25—27 день) на участках апикальных частей люминальных клеток, обращенных в полость альвеолярной почки или протока, увеличивается число микровилл. Внутри клеток возрастает объем шероховатого эндоплазматического ретикулума, количество секреторных вакуолей и гранул гликогена. В альвеолярных почках наблюдается интенсивная апокриновая секреция. В результате чего полости в альвеолярных почках и протоках заметно расширяются и, соответственно, их стенки растягиваются. Количество клеток с митотической активностью увеличивается. Число альвеолярных почек, образованных терминальным протоком, увеличивается и, кроме долек, содержащих 11 альвеолярных почек, появляются дольки, имеющие в среднем 47 и 81 альвеолярную почку. Эти дольки получили название молочных долек II и III типа (Russo, Russo, 2004) (рис. 1.10). Отечность и инфильтрат увеличиваются в интралобулярной строме.
Результаты по определению пролиферативной активности клеток молочной железы в различные фазы менструального цикла авторадиографическим методом с помощью метки к тимидину (3Н-тимидин) (Going et al., 1988; Potten et al., 1988), а также по пролиферативному индексу, определяемому как число Ki-67 (маркер клеточной пролиферации) позитивно окрашиваемых ядер в 1000 клеток (Navarrete et al., 2005), дополнительно свидетельствуют о наивысшей дифференциации клеток в лютеиновую фазу цикла. Поскольку дифференциация, а также пролиферация клеток молочной железы в значительной степени связана с гормональным фактором, представляют большой интерес данные о локализации клеточных рецепторов к гормонам в тканях молочной железы, а также динамики распределения их плотности в зависимости от фазы менструального цикла. К настоящему времени имеется.
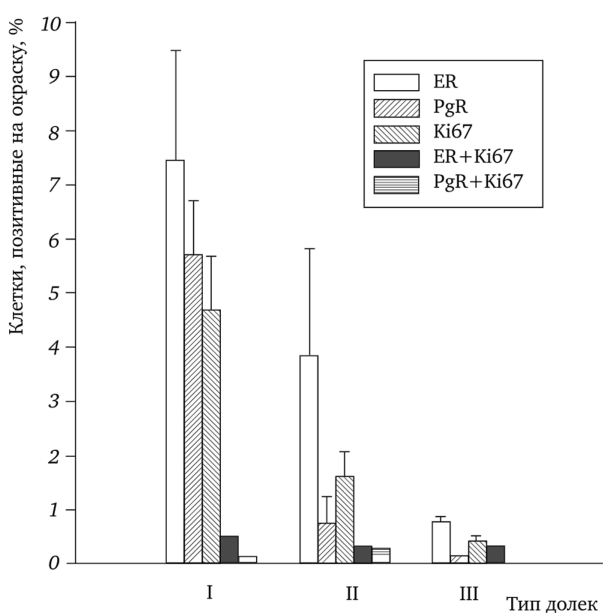
Рис. 1.10. Процент клеток альвеолярных почек, позитивных на окраску для эстрогеновых рецепторов (ER), прогестероновых рецепторов (PR), Ki67 и позитивных одновременно для ER и Ki67 (ER + Ki67), PR и Ki67 (PR + Ki67) в долях разного типа (по Russo et al., 1969).
несколько иммуноцитохимических исследований, в которых достаточно подробно была изучена локализация клеточных рецепторов к стероидным гормонам в нормальных молочных железах. Образцы для исследований брались в связи с редукционной маммопластикой или в участках молочных желез, находящихся рядом с фиброаденомами (Speirs et al., 2002; Li et al., 2010). Однако, как отмечают сами авторы, менструальный статус женщин, у которых анализировались образцы тканей молочных желез, был не известен. Согласно полученным данным (Li et al., 2010), окраска на ERa-рецепторы наблюдается в 10% в ядрах эпителиальных клеток внутреннего слоя альвеолярных почек и внешнего слоя интерлобулярных протоков. Окраска на ERPрецепторы отмечается в 70—85% в ядрах эпителиальных клеток обоих слоев, в альвеолярных почках и протоках, а также в стромальных клетках (Speirs et al., 2002; Li et al, 2010). Окраска на PRA обнаруживается в ядрах эпителиальных клеток внутреннего слоя альвеолярных почек и внешнего слоя клеток интерлобулярных протоков, а также отмечается и в цитоплазме клеток. Локализация PRB аналогична PRA, но сосредоточена только в ядрах эпителиальных клеток. В клетках стромы окраска на прогестероновые рецепторы не отмечалась (Li et al., 2010). Исследования динамики рецепторов к стероидным гормонам в различные фазы менструального цикла менее детальны и были проведены только в фолликулярную и лютеиновую фазы (Soderqvist, 1998; Shaw et al., 2002). Оказалось, что изменение количества окрашенных ядер клеток тканей молочной железы наиболее выражено только для ERa. В частности, число окрашенных ядер на ERa-рецепторы значительно выше в клетках долек и протоков в раннюю фолликулярную фазу. С увеличением концентрации эстрадиола в крови уровень окрашенных ядер на ERa снижается и достигает наименьшего значения в лютеиновую фазу. Для ядер клеток, окрашенных на ERP-рецепторы и прогестероновые рецепторы, заметной разницы в их распределении в тканях молочной железы между фолликулярной и лютеиновой фазами не отмечалось. Здесь следует отметить, что имеются достаточно подробные данные о распределении и изменении плотности рецепторов к стероидным гормонам в различные фазы менструального цикла, полученные на обезьянах (макаках) (Cheng et al., 2005). Строение молочной железы (Macpherson, Montagna, 1974), сроки и течение менструального цикла, а также динамика и значения концентраций стероидных гормонов в фазы менструального цикла (Bosu et al., 1973; Atkinson et al., 1975; Cline, 2007) у этих приматов в значительной степени совпадают с соответствующими показателями у женщин. Во время менструального цикла у обезьян уровень экспрессии ERa в ядрах эпителиальных клеток долей и протоков, так же как и в молочных железах женщин, самый высокий в начальный период фоликулярной фазы и составляет 12,5%. Затем снижается в позднюю фолликулярную фазу до 3,3% и лютеиновую фазу — до 1,2%. В ядрах эпителиальных клеток выстилающих протоки значения были соответственно 7,5; 1,4 и 0,4%. Изменение экспрессии ER (3 происходит в обратном направлении относительно ERa. В раннюю фолликулярную фазу экспрессия ER (3 наблюдается у незначительного числа эпителиальных клеток. Однако в позднюю фолликулярную фазу экспрессия увеличивается до 62%, а в лютеиновую фазу — до 82%. Помимо эпителиальных клеток в позднюю фолликулярную фазу и лютеиновую фазу ERJ3 экспрессируются в ядрах миоэпителиальных клеток и фибробластов. PRA и PRB присутствуют главным образом в ядрах эпителиальных клеток долей и протоков. Небольшое количество ядер стромальных клеток экспрессирует PRA или PRB. В различные фазы менструального цикла PRA и PRB экспрессируются одинаковым образом. Так экспрессия на PRA и PRB увеличивается от 4% в раннюю фолликулярную фазу, до 13% в позднюю фолликулярную фазу и достигает 17% в лютеиновую фазу менструального цикла. Таким образом, в отличие от ERa между динамикой экспрессии ER (3, PRA и PRB в тканях молочной железы обезьян и женщин отмечается заметная разница. Неясно, обусловлено ли это расхождение методическими причинами или данная разница связана с видовыми особенностями. В связи с этим необходимо отметить чрезвычайно важные данные, полученные X. Руссо с сотрудниками (Russo et al., 1999), по исследованию распределения ERa и прогестероновых рецепторов в долях молочной железы различного типа. Оказалось, что содержание ERa и PR прямо пропорционально уровню пролиферации клеточных структур, входящих в дольку (см. рис. 1.10). Так, количество рецепторов максимально в клетках долек I типа, имеющих наивысшую пролиферативную активность, которая прогрессивно уменьшается при дифференциации долек I типа в дольки II и III типа с одновременным снижением числа рецепторов. Поскольку определение рецепторов в клетках, образующих молочные дольки в молочных железах женщин, к стероидным гормонам определялось без соотношения к типам долек, это могло быть причиной расхождения в полученных результатах у различных авторов.
Данные о локализации рецепторов к пролактину в нормально функционирующей молочной железе небеременных женщин фрагментарны и содержатся в единичных работах (Gill et al., 2001; Ueda et al., 2011). Окраска на пролактиновые рецепторы (PrlR) отмечалась на участках мембран эпителиальных клеток, выходящих в полость альвеолярных почек и протоков. Менструальный статус женщин, у которых брались образцы железистой ткани, был неизвестен.
Сведения о рецепторах к окситоцину в нормально функционирующей молочной железе небеременных женщин также немногочисленны (Kimura et al., 1998; Bussolati et al., 1996; Reversi et al., 2006). Окраска на окситоциновые рецепторы (OR) была обнаружена в ограниченных участках миоэпителиальных клеток альвеол и протоков, а также эпителиальных клетках. Плотность OR была весьма низкая. Количественной оценки OR не производилось. Менструальный статус женщин, у которых брались образцы железистой ткани, был неизвестен.
Поскольку светомикроскопический метод имеет определенные ограничения, представляют существенный интерес сведения об изменении ультраструктуры тканей молочной железы женщины в течение менструального цикла. В литературе имеется достаточно большое количество работ, появившихся главным образом в 1970—1980;е гг., посвященных электронно-микроскопическому исследованию молочной железы женщин. Однако основная часть экспериментального материала в этих обследованиях была взята из участков молочной железы с какой-либо патологией или находящихся рядом с ними (Stirling, Chandler, 1976). И самое главное, в ультраструктурных исследованиях не было такой четкой «привязки» взятого материала ко времени менструального цикла, как это было сделано в некоторых работах на светомикроскопическом уровне. К настоящему времени сведения об ультраструктуре молочной железы на различных стадиях менструального цикла имеются лишь в одной работе (Fanger, Ree, 1974). Материал для обследования брался из участков, вырезанных из биопсийных образцов, находившихся в железистой ткани рядом с фиброаденомами или кистами. Основное внимание в данной работе было сосредоточено на ультраструктуре эпителиальных клеток, образующих стенки протоков и альвеолярных почек. Оказалось, что в отличие от светомикроскопических данных в раннюю фолликулярную фазу (второй — четвертый день) клетки, образующие стенки протоков, остаются полностью дифференцированными. Часть клеток апикальными поверхностями выходят в значительной степени суженные полости протоков. Другая часть, меньшая, прилегает к базальным или латеральным частям этих клеток. Ядра клеток, сообщающихся с полостью, имеют овоидную или грушевидную форму. В цитоплазме присутствуют в небольшом количестве рибосомы. Шероховатый эндоплазматический ретикулум содержит узкие не заполненные или включающие небольшое количество гранулярного материала цистерны. Аппарат Гольджи состоит из недостаточно развитых пустых трубчатых пластинок. В цитоплазме отмечаются редкие митохондрии, секреторные везикулы, гранулы гликогена и жировые капли. Таким образом состояние внутриклеточных структур указывает на то, что функциональная активность клеток снижена. Эпителиальные клетки довольно плотно прилегают друг к другу. На участках клеток, выходящих в полость, микровиллы практически отсутствуют. В соответствии с данными, представленными на рис. 1.9, концентрация прогестерона и эстрогена в этот период находится на базальном уровне. Содержание пролактина повышено, но к четвертому дню фолликулярной фазы происходит снижение его до базальной концентрации.
Ближе к овуляторной фазе (10—15-й день) эпителиальные клетки становятся более вытянутыми и объем их увеличивается. На апикальных участках, выходящих в полость появляются микровиллы. Однако по количеству и развитию внутриклеточных структур наблюдается сходство с клетками ранней фолликулярной фазы. В это время отмечается начало повышения в крови женщин концентрации эстрогена, пролактина и окситоцина (см. рис. 1.9).
В начале лютеиновой фазы (17—19-й день) происходит расширение полостей в протоках, а также увеличение числа и размеров микровилл на апикальных участках эпителиальных клеток. Вместе с тем за исключением повышения содержания гликогеновых гранул по числу и развитию внутриклеточных структур нет заметных различий по сравнению с клетками ранней фолликулярной фазы.
С приближением к концу лютеиновой фазы (20—25-й день), когда в крови женщин концентрация эстрогена и прогестерона начинает снижаться к базальному уровню, а уровень пролактина повышаться (см. рис. 1.9), эпителиальные клетки молочной железы достигают своего наивысшего развития. В частности, увеличиваются размеры ядер клеток, их поверхность становится неровной. Повышается число рибосом, а также полисом. Цистерны шероховатого ретикулума расширены и заполнены электронно-плотным материалом. Во многих клетках комплекс Гольджи разрастается, состоит из хорошо развитых трубчатых пластин и содержит агрегаты пузырьков. Количество микровилл на апикальной части значительно увеличивается и они достигают максимальных размеров. Вместе с тем на снимках не представлены примеры апокриновой секреция, о которой говорится в светомикроскопических исследованиях. Возможно, это связано с тем, что секреция достигает максимума в последние дни лютеальной фазы (25—27-й день). Однако ультраструктурные данные на этот период цикла у авторов (Fanger, Ree, 1974) отсутствовали.
Более подробные ультраструктурные исследования различных типов клеток молочных желез были проведены на нормальных молочных железах только во время лютеиновой фазы. Стенки альвеолярных почек, тонких терминальных протоков, междольковых протоков и самых широких протоков, подходящих к соску, имеют в этот период одинаковое строение и образованы эпителиальными и миоэпителиальными клетками (Ozello, 1974; Stirling, Chandler, 1976, 1977; Watson et al., 1988; Tsuchiya, Li, 2005). Среди эпителиальных клеток были выделены три группы. К первой группе были отнесены клетки, форма которых варьирует от кубоидной до цилиндрической. Длинные оси данных клеток располагаются радиально к полости протоков. Апикальные поверхности этих клеток содержат многочисленные микровиллы различной формы и длины и граничат с полостью протоков. Плотность микровилл имеет тенденцию к увеличению у клеток терминальных протоков и альвеолярных почек. Эпителиальные клетки первой группы в зависимости от их электронной плотности подразделяются на темные и светлые. Полагают, что разница в электронной плотности связана с различным функциональным состоянием. Их внутриклеточные структуры по развитию и строению мало чем отличаются от внутриклеточных структур эпителиальных клеток в лютеиновую фазу, обнаруженных предыдущими авторами (Fanger, Ree, 1974). Эпителиальные клетки первой группы соединены между собой системой плотных контактов, обеспечивающих изоляцию полостей протоков от окружающей их внутри и междольковой среды. Во вторую и третью группу относят клетки со светлой цитоплазмой, которые локализуются между базальными участками клеток первой группы и миоэпителиальными клетками. Клетки второго типа располагаются более рыхло и не образуют плотных контактов с соседними клетками. Вторая группа клеток имеет внутреннюю структуру, сходную со структурой темных эпителиальных клеток. Предполагается, что второй тип клеток является прогениторами (предшественниками) для эпителиальных клеток первой группы и миоэпителиальных клеток. Третий тип эпителиальных клеток был идентифицирован как лимфоциты и макрофаги (Ferguson, 1985). В стенках альвеолярных почек и протоков нелактирующей («покоящейся») молочной железы процент лимфоцитов и макрофагов относительно всей клеточной популяции варьирует от 5 до 15%, причем большинство из этих клеток составляют лимфоциты (Ferguson, 1985).
Миоэпителиальные клетки формируют сетчатую структуру, оплетая альвеолярные почки и протоки своими цитоплазматическими отростками, между которыми наблюдаются десмосомы. На стенках протоков отростки миоэпителиальных клеток располагаются главным образом вдоль продольной оси протока. Для миоэпителиальных клеток характерно наличие многолопастного ядра. Цитоплазма миоэпителиальных клеток в лютеиновую фазу содержит те же органеллы, что и эпителиальные. Характерной чертой внутренней структуры миоэпителиальных клеток является присутствие большого количества филаментов, которые сходны по строению с миофиламентами гладкомышечных клеток. Особенностью миоэпителиальных клеток явилось наличие у них специальных волосков — цилий (Stirling, Chandler, 1976), сходных по строению с киноцилиями волосковых клеток слуховой или вестибулярной системы у некоторых животных (Barber, 1974). Внутри цилий по периферии располагались девять пар фибрилл, центральная пара фибрилл отсутствовала. Цилии проникали внутрь клетки и были связаны с базальным тельцем. Цилии локализовались на поверхности миоэпителиальной клетки, обращенной к базальным сторонам эпителиальных клеток. Диаметр цилий был около 250 нм, наибольшая длина их составила 830 нм. Цилии наблюдались у миоэпителиальных клеток, находящихся во всех участках протоковой системы молочной железы. Следует отметить, что цилии были обнаружены на миоэпителиальных клетках и у других млекопитающих (McDermott et al., 2010). Наиболее подробно их функция была исследована при развитии молочных желез мышей. Оказалось, что в процессе морфогенеза протоковой системы молочных желез цилии обнаруживаются не только у миоэпителиальных клеток, но и у эпителиальных и стромальных клеток. Дефекты внутрицилиарного транспорта у мышей мутантов проявлялись в нарушении ветвления протоков молочных желез в процессе морфогенеза (McDermott et al., 2010). У нормальных мышей после завершения морфогенеза протоков цилии остаются только у миоэпителиальных клеток. Полагают, что цилии в процессе морфогенеза протоков осуществляют координирующую функцию между клетками молочных протоков (McDermott et al., 2010). В зрелой молочной железе они, по-видимому, выполняют механорецепторную функцию и служат для согласования механических смещений стенок молочных протоков в процессе выведения молока (Stirling, Chandler, 1976). Миоэпителиальные клетки имели заметную разницу по форме в зависимости от места их локализации (Stirling, Chandler, 1977; Tsuchiya, Li, 2005). Так, миоэпителиальные клетки, расположенные на толстых протоках, находящихся под ареолярной областью, часто формировали довольно длинные отростки, погруженные в строму. В то время как на альвеолярных почках и тонких протоках контакт миоэпителиальных клеток со стромой имел плоскую форму.
Клеточный слой, образующий стенки протоков и альвеолярных почек, полностью покрыт базальной мембраной, а точнее базальной оболочкой. Базальная оболочка состоит из двух слоев, получивших название светлого (lamina lucida) толщиной 15—30 нм и темного (lamina densa) толщиной 40—80 нм (Tsuchiya, Li, 2005). Миоэпителиальные клетки контактируют с базальной оболочкой, образуя полудесмосомы.
Участки эпителиальных клеток подходят также близко к базальной оболочке, но формирование полудесмосом не отмечено. К базальной оболочке через промежуток, заполненный коллагеновыми волокнами, прилегает слой фибробластов, отделяющий внутридольковые протоки и альвеолярные почки от внутридольковой стромы. К фибробластовому слою со стороны стромы подходят капилляры. Внутридольковая строма содержит большое количество коллагеновых фибрилл. Кроме фибробластов и капилляров, во внутридольковой строме располагаются макрофаги, лимфоциты, тучные клетки (Ferguson, 1985) и сравнительно недавно идентифицированные клетки Кахаля, или точнее напоминающие по строению клетки Кахаля (interstitial Cajal-like cell (ICLC)) (Gherghiceanu, Popescu, 2005). Здесь необходимо отметить, что в более ранних работах (Eyden et al., 1986) ICLC рассматривались как разновидность фибробластов. Однако детальные исследования на ультраструктурном уровне обнаружили существенные различия между этими типами клеток. Так, ICLC имеют два-три довольно длинных, в несколько десятков мкм, цитоплазматических отростка. Толщина их составляет 0,1—0,5 мкм и, возможно, они имеют расширения. Большую часть клетки занимает ядро, эндоплазматический ретикулум главным образом гладкий, имеет небольшой объем и достигает примерно 7% от объема клетки. Объем митохондрий составляет около 10% объема клетки. ICLC локализуются по всему объему внутридольковой стромы и посылают свои отростки к различным клеткам стромы, образуя с ними контакты, а также окружают капилляры и молочные протоки. Фибробласты имеют многочисленные короткие цитоплазматические отростки. Внутри клетки митохондрии занимают около 6% объема, но объем эндоплазматического ретикулума (шероховатого) почти в три раза больше (17%), чем в ICLC. Фибробласты в отличие от ICLC располагаются в основном в пограничной области между молочными протоками и молочными почками и остальной частью внутридольковой стромы.
Междольковая строма также содержит большое количество коллагеновых волокон, но по сравнению с внутридольковой стромой «бедна» клеточными структурами. В ней располагаются кровеносные и лимфатические сосуды и группы жировых клеток. Согласно светомикроскопическим данным, строма подвергается заметным изменениям в объеме и плотности в течение цикла. Исследования ультраструктуры внутри междольковой стромы в различные фазы цикла (Stoeckelhuber et al., 2002) показали, что коллагеновые фибриллы внутридольковой стромы лежат рыхло и проходят в различных направлениях. Толщина фибрилл равна примерно 45 нм. Коллагеновые фибриллы междольковой стромы толще (52 нм в диаметре) и располагаются более упорядоченно, параллельно друг другу. Коллагеновые волокна скрепляются поперечными белковыми нитями 4—8 нм диаметром, которые были идентифицированы как дерматансульфаты — протеогликаны. Места прикрепления дерматансульфат протеогликановых белков локализуются на d-участках коллагеновых волокон. Расстояние между местами прикрепления дерматансульфат протеогликановых белков у коллагеновых волокон интралобулярной и интерлобулярной стромы одинаково и постоянно в фолликулярную фазу цикла и составляет 46 нм. В лютеиновую фазу это расстояние увеличивается на 9 нм. Причем увеличение в расстоянии более характерно для рыхлой интралобулярной стромы. Полагают, что изменение в расстоянии происходит вследствие увеличения содержания воды в межколлагеновом пространстве под действием стероидных гормонов (Stoeckelhuber et al., 2002). Здесь следует отметить, что пролактин, помимо лактогенного действия, принимает участие и в осморегуляции в молочной железе (Shennan, 1994). Поскольку содержание пролактина повышается во вторую половину лютеиновой фазы цикла, то можно предположить, что этот гормон также может влиять на содержание воды в строме. Предполагается, что увеличение содержания воды в интралобулярной строме имеет существенное значение для развития и функционирования железы в лютеиновую фазу. Так, согласно приведенным выше ультраструктурным данным, внутриклеточные секреторные процессы в конце лютеиновой фазы интенсифицируются. В связи с этим необходимо дополнительное поступление из кровотока в клетки различных органических и минеральных веществ, а также кислорода. Поскольку данный процесс осуществляется путем диффузии через межклеточную среду, увеличение жидкости вокруг железистой ткани будет способствовать транспорту необходимых веществ в клетки ацинусов и протоков (Stoeckelhuber et al., 2002).
Кроме гормонов, другие факторы влияют на развитие молочной железы женщин в период до наступления менопаузы. В частности, рецепторы к эпидермальному фактору роста максимально экспрессируются в лютеиновую фазу цикла главным образом на стромальных и миоэпителиальных клетках. Сверх того, в люминальных клетках альвеолярных почек и протоков активируется Stat5 (сигнальный трансдуктор и активатор транскрипции). Он регулирует экспрессию клеточных рецепторов к пролактину и может предотвращать апоптоз при дифференциации эпителиальных клеток (Nevalainen et al., 2002).
Помимо усиления пролиферативных процессов, в тканях молочной железы женщины к концу лютеиновой фазы происходит увеличение васкуляризации и скорости кровотока (Madjar et al., 1992; Weinstein et al., 2005).
Таким образом, разрастание железистой и стромальной ткани молочной железы, заполнение секретом полостей альвеолярных почек и протоков, появление отечности в интерлобулярной строме, увеличение васкуляризации и интенсивности кровотока вызывают повышение объема и плотности молочной железы перед менструацией (Milligan et al., 1975; Fowler et al., 1990). По аналогии с «неонатальным нагрубанием» данное состояние железы перед менструацией можно назвать «предменструальным нагрубанием», что является нормальным физиологическим процессом, причем степень «предменструального нагрубания» варьирует среди женщин. Клинические обследования показывают, что в одних случаях наблюдается незначительное повышение плотности желез. В других случаях некоторые женщины испытывают в это время весьма ощутимый дискомфорт. Женщина чувствует распирание, тяжесть в железе, при пальпации желез прощупываются уплотнения, при этом часто возникают болезненные ощущения. В клинике данное явление получило название циклической масталгии (Smith et al., 2004). Необходимо отметить, что ощущения распирания и боли могут возникнуть только при поступлении в кору головного мозга женщины нервной импульсации от афферентных рецепторов, находящихся во внутренней части молочной железы. Поэтому причиной возникающих ощущений является раздражение главным образом механорецепторов и болевых рецепторов, располагающихся в непосредственной близости к стенкам молочных протоков (Eriksson et al., 1996). Причем интенсивность ощущений будет зависеть от степени заполнения протоков секретом и, соответственно, растяжения стенок молочных протоков. При различном объеме секрета, образующегося в лютеиновую фазу цикла у женщин, секретирующих большее количества секрета, растяжение стенок протоков и, соответственно, раздражение механорецепторов будет интенсивнее, а при достаточно сильном растяжении будут активироваться болевые рецепторы. В случае малой интенсивности секреции увеличение объема протоков будет незначительным, соответственно, и ощущения будут малозаметными или вообще отсутствовать. Данные предположения согласуются с результатами исследований по изучению зависимости болевых ощущений в молочной железе от диаметра молочных протоков у женщин во вторую половину менструального цикла (Peters et al., 2003). В частности, оказалось, что болевые ощущения у женщин с циклической масталгией в прямой пропорции коррелируют с диаметром молочных протоков. Несомненно, определенный вклад в формирование ощущения «наполненности» железы в лютеиновую фазу будет вносить раздражение механорецепторов кровеносных и лимфатических сосудов. Здесь необходимо добавить, что имеются экспериментальные данные (Robinson, Short, 1977), указывающие на изменение чувствительности к тактильным и болевым стимулам внешних покровов молочной железы в лютеиновую фазу в результате повышения концентрации прогестерона и эстрогена (см. рис. 1.9). Однако механизмы этого явления до сих пор не известны.
Если зачатие ребенка не случилось, желтое тело прекращает функционировать, подвергается атрезии, уменьшается уровень эстрогенов и прогестерона. Вследствие этого происходит регрессия железистой и стромальной тканей молочной железы. Уменьшаются васкуляризация и интенсивность кровотока, исчезает отечность. Строма уплотняется, объем молочной железы уменьшается. Затем в следующий цикл развитие молочной железы повторяется. Здесь важно отметить, что, согласно наблюдениям, после окончания цикла ткани молочной железы женщины никогда не возвращаются к первоначальному состоянию, а остаются несколько увеличенными (Russo, Russo, 2004). Причем за каждый цикл число альвеолярных почек повышается, что ведет к увеличению размера долек или образованию новых. Этот процесс длится в молочных железах женщин примерно до 35 лет (Russo, Russo, 2004). В результате циклического развития молочной железы у нерожавших женщин в железистой ткани отмечаются дольки I, II и III типа (Russo, Russo, 2004). Морфометрические исследования обнаружили, что с увеличением числа альвеолярных почек в дольках количество клеток, образующих стенки почки, уменьшается. Так, на поперечном срезе альвеолярной почки в дольках I типа насчитывается около 34 клеток, в II и III типах долек соответственно 13 и 11 (Russo, Russo, 2004). Исследование железистой ткани у женщин с овуляторным циклом показывает большое разнообразие в строении и содержании долькоальвеалярных структур. В частности, в железистой ткани обнаруживаются отдельные недифференцированные терминальные почки и альвеолярные почки, которые не подвергаются дальнейшему развитию, если не происходит беременность, молочные дольки I, II и III типа. Это положение хорошо иллюстрирует схема на рис. 1.11 (Russo, Russo, 2004).
С установлением у женщин регулярных циклов начинают проявляться добавочные молочные железы (см. рис. 1.3). Так же как основные молочные железы, добавочные железы увеличиваются в объеме в лютеиновую фазу цикла. Подкожные участки, где находятся железы, становятся плотными. При нажатии на них в некоторых случаях возникают болевые ощущения.
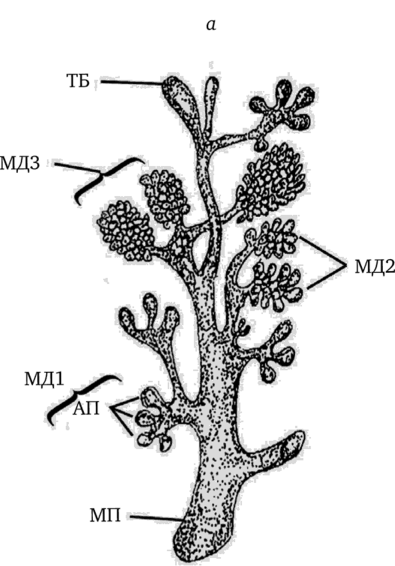
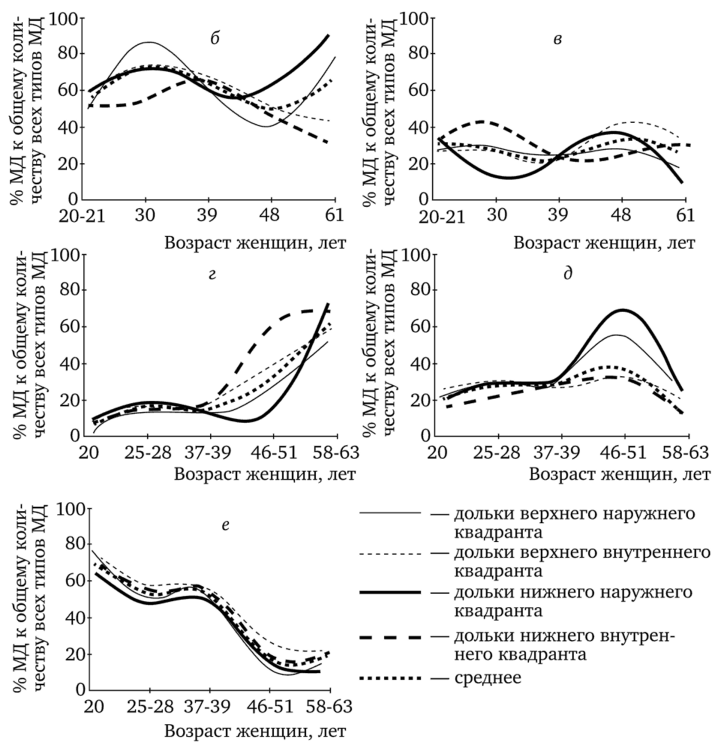
Рис. 1.11. Схематическое представление дольковых структур в молочной железе женщины (а) и изменение их количества у нерожавших (б, в) и рожавших женщин (г, д, е) (по Russo, Russo, 2004).
а: ТБ — терминальная луковица, МД1, МД2 и МДЗ — соответственно молочные дольки I, II и III типа, АП — альвеолярные почки, МП — молочный проток; б — процент МД1 в четырех квадрантах молочной железы у нерожавших женщин; в — процент МД2 в четырех квадрантах молочной железы у нерожавших женщин; г — процент МД1 в четырех квадрантах молочной железы у рожавших женщин; д — процент МД2 в четырех квадрантах молочной железы у рожавших женщин; е — процент МДЗ в четырех квадрантах молочной железы у рожавших женщин.