Значение ОВ-реакций в сельскохозяйственном анализе
Пример 1. Рассчитайте реальный ОВ-потенциал системы, полученной при смешивании 80 мл раствора соли церия (IV) в концентрации с'(Се4+) = 0,150 моль/л с 20 мл раствора, содержащего церий (Ш) в концентрации с'(Се3+) = 0,050 моль/л. Коэффициенты активности ионов Се4+ и Се3+ считать равными единице. При Т = 298 К стандартный ОВ-потенциал редокс-пары Се4+ |Се3+ равен 1,77 В. Решение. Согласно уравнению… Читать ещё >
Значение ОВ-реакций в сельскохозяйственном анализе (реферат, курсовая, диплом, контрольная)
Окислительно-восстановительные процессы играют особую роль в жизнедеятельности клетки и биосферы. Ферменты, относящиеся к классу оксидоредуктаз, катализируют ОВ-реакции, играющие важную роль в биохимических процессах в клетках живых организмов и в почве. Их активность находится в тесной зависимости с основными физико-химическими свойствами, микробиологическими процессами в почве, нитрификацией, сульфофикацией. Нитрификация может быть изображена следующей схемой:

В агрохимических исследованиях крайне важно изучение влияния различных факторов на протекание этих процессов, которые определяют степень обеспеченности растений питательными веществами.
Почвы содержат большое число окислительно-восстановительных систем, среди которых наиболее важны соединения железа в степенях окисления +2 и +3; марганца (+ 2, +3, +4); серы (+6, +4, -2); азота (+5, +3, -3).
Соотношение этих систем в почве определяет ее окислительно-восстановительный потенциал (ОВП), от которого зависит рост и развитие растений.
Одной из задач аналитической химии в сельскохозяйственном анализе является определение ОВП почв для разработки рекомендаций по его регулированию, улучшению плодородия почвы.
Окислительно-восстановительные реакции лежат в основе методов анализа почв и различных биологических объектов на содержание органических веществ, азота, фосфора, серы, железа, марганца, хрома, молибдена.
Примеры расчетов
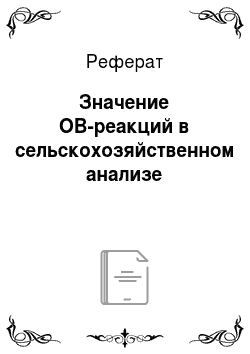
Пример 1. Рассчитайте реальный ОВ-потенциал системы, полученной при смешивании 80 мл раствора соли церия (IV) в концентрации с'(Се4+) = 0,150 моль/л с 20 мл раствора, содержащего церий (Ш) в концентрации с'(Се3+) = 0,050 моль/л. Коэффициенты активности ионов Се4+ и Се3+ считать равными единице. При Т = 298 К стандартный ОВ-потенциал редокс-пары Се4+ |Се3+ равен 1,77 В.
Решение. Для указанной редокс-пары ОВ-процесс можно описать полуреакцией.
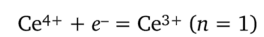
Реальный ОВ-потенциал для этой редокс-пары выражается при комнатной температуре уравнением Нернста (5.5):
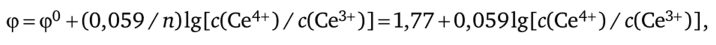
поскольку в данном случае ф° = 1,77 В, п = 1, активности компонентов равны концентрациям, так как коэффициенты активности равны единице.
Найдем отношение концентраций с (Се4+)/с (Се3+) в растворе, полученном после смешивания исходных растворов. Очевидно, что.
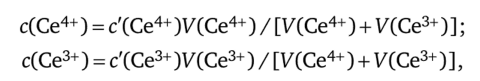
где объемы исходных растворов V (Ce4+) = 0,080 л, V (Ce3+) = 0,020 л.
Тогдас (Се4+) /с (Се3+) = [c'(Ce4+)V (Ce4+)] / [с (Ce3+)V (Ce3+)] = [0,150х х 0,080] / [0,050 • 0,020] = 12;
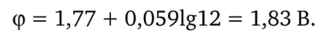
Пример 2. Рассчитайте реальный ОВ-потенциал электрода, опущенного в раствор, в котором активности ионов МПО4 и Мп2+ одинаковы, a pH 1. При Т = 298 К стандартный ОВ-потенциал редокс-пары Мп04, Н+ |Мп2+ равен 1,51 В.
Решение. В ОВ-процессе (в полуреакции).
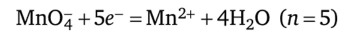
участвуют, в отличие от предыдущего примера, ионы водорода, поэтому реальный ОВ-потенциал редокс-пары зависит от активности ионов водорода ф = ф° +(0,059/n)lg[a (Mn04)a8(H+)/a (Mn2+)]. Согласно условию a (Mn04) = a (Mn2+); 71 = 5; a (H+) = 10-рн =10-1. Поэтому.
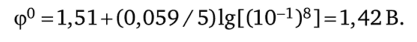
Пример 3. Рассчитайте, чему равно соотношение активностей окисленной и восстановленной форм редокс-пары Fe3+ | Fe2+ в водном растворе, если известно, что для этой редокс-пары при Т = 298 К реальный и стандартный ОВ-потенциалы равны соответственно Ф = 0,71 В и ф° = 0,77 В.
Решение. Для рассматриваемой редокс-пары можно записать:
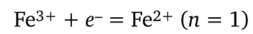
Реальный ОВ-потенциал при Т = 298 К равен 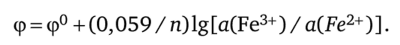 Следовательно,.
Следовательно,.
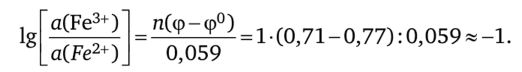
Отсюда.
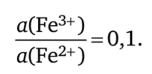
Пример 4. Покажите, можно ли в стандартных состояниях веществ окислить хлорид-ионы СП перманганат-ионами МПО4 в кислой среде при Т = 298 К. Стандартные ОВ-потенциалы редокс-пар МПО4, Н+ | Мп2+ и С1212С1- равны соответственно 1,51 и 1,36 В.
Решение. Реакцию окисления хлорид-ионов перманганат-ионами в кислой среде можно записать в виде.
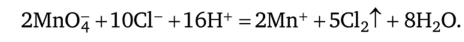
Чтобы эта реакция протекала в прямом направлении, потенциал реакции должен быть положителен. В рассматриваемом случае все реагенты находятся в стандартных состояниях, поэтому потенциал реакции равен ее стандартному потенциалу Е°. Согласно (5.8) для стандартного потенциала рассматриваемой реакции имеем Е° - ср^ -ф®, где ф^иф^ — соответственно стандартные потенциалы редокс-пар Мп04, Н+|Мп2+ и С1212СН Подставляя в это уравнение числовые значения стандартных потенциалов обеих редокс-пар, получаем: Е° = 1,51 — 1,36 = 0,15 В.
Поскольку стандартный потенциал реакции Е° > 0, то реакция протекает в прямом направлении, т. е. в стандартных состояниях хлоридионы в кислой среде окисляются перманганат-ионами. В рассмотренном примере, как и в других аналогичных случаях, за ф^ (или ф:) принимается ОВ-потенциал той редокс-пары, окисленная форма которой выступает в роли окислителя в данной реакции при ее протекании в прямом направлении. За ф^ (или ф2) принимается ОВ-потенциал редокс-пары, восстановленная форма которой выступает в роли восстановителя в данной реакции.
Пример 5. Рассчитайте константу равновесия К реакции.
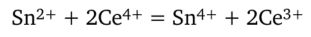
протекающей в водном растворе при Т = 298 К. Стандартные ОВ-потенциалы редокс-пар Се4+ | Се3+ и Sn4+ | Sn2+ при Т = 298 К соответственно равны 1,77 и 0,15 В.
Решение. Согласно уравнению (5.11) для десятичного логарифма константы равновесия имеем: 1 gK = пЕ° / 0,059, где п — число электронов, принимающих участие в данной ОВ-реакции; Е° — стандартный потенциал этой реакции, равный в данном случае Е° = 1,77 — - 0,15 = 1,62 В. Подставляя это значение Е° в выражение для lgК и учитывая, что п = 2, получаем.
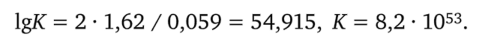
Реакция протекает в прямом направлении.
Пример 6. Оцените полноту окисления железа (П) при Т = 298 К двумя разными окислителями: раствором сульфата церия (П) и раствором азотной кислоты HN03. При Т = 298 К стандартные ОВ-потенциалы редокс-пар Се4+|Се3+; Fe3+|Fe2+ и NO§, H+ |NO равны соответственно 1,77; 0,77 и 0,96 В.
Решение. Полноту окисления железа (II) в двух рассматриваемых реакциях.
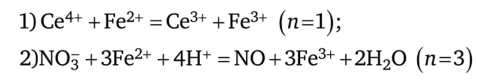
можно оценить, сравнивая константы равновесия этих реакций Кг и К2.
В соответствии с уравнением (5.12) эти константы равны:
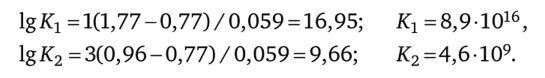
Отношение К1/К2= 8,9 1016 /4,6 109 =1,9−107.
Таким образом, сульфат церия (IV) полнее окисляет железо (II), чем азотная кислота.