Кинетика процесса выщелачивания

При отсутствии диффузионных торможений процесс выщелачивания может лимитироваться скоростью химической реакции, протекающей, на поверхности твердого тела. Химическая реакция, являясь одной из стадий гетерогенного процесса, сама в свою очередь протекает через определенные стадии и, следовательно имеет свой собственный механизм. Механизмы химических реакций отличаются большим разнообразием… Читать ещё >
Кинетика процесса выщелачивания (реферат, курсовая, диплом, контрольная)
Выщелачивание — гетерогенный процесс, в котором участвуют по меньшей мере две фазы: твердое вещество и раствор. Гетерогенные процессы отличаются от гомогенных тем, что они проходят не во всем объеме системы, а на определенных ее участках, например, на границе раздела фаз. Поэтому для непрерывного протекания реакции необходим непрерывный подвод реагирующих веществ к этим участкам и отвод от них продуктов реакции. Этим объясняется сложность гетерогенных процессов, состоящих из нескольких последовательных стадий и помимо собственно химической реакции включающих в себя также стадии диффузии исходных реагентов и конечных продуктов. Совокупность всех стадий, из которых складывается гетерогенный процесс в целом, называется механизмом этого процесса.
Из учения о химической кинетике известно, что скорость наиболее медленной стадии определяет скорость всего процесса. Поэтому выяснение механизма процесса и его самой медленной стадии является хотя и трудной, но весьма важной задачей изучения кинетики любого процесса.
Если самая медленная стадия гетерогенного процесса — собственно химическая реакция, то скорость всего процесса определяется исключительно скоростью этой химической реакции. В этом случае принято говорить, что процесс протекает в кинетической области. К гетерогенным процессам, протекающим в кинетической области, могут быть применены кинетические уравнения гомогенных реакций с тем лишь отличием, что действующей станет не объемная концентрация, а поверхностная.
Если же скорость диффузии значительно меньше скорости химической реакции, то определяющим этапом будет диффузия, и процесс протекает в диффузионной области. Скорость всего процесса при этом определяется законами диффузии. И, наконец, если скорости диффузии и химической реакции соизмеримы, то процесс протекает в смешанной области, и скорость его определяется как законами диффузии, так и законами химической кинетики.
Следует, однако, помнить, что когда мы говорим о различиях в скоростях диффузии и химической реакции, характеризуя одну из них как быструю, а другую как медленную, это не означает реального неравенства скоростей этих стадий во время протекания данного процесса. В действительности по условиям материального баланса в стационарно протекающем процессе скорости диффузии и химической реакции равны, и словами «быстрый» и «медленный» мы характеризуем только потенциальные возможности этих стадий. Так, при быстрой диффузии и медленной химической реакции у поверхности растворяющегося твердого тела устанавливается такое состояние, при котором диффузия могла бы протекать быстрее, но медленная химическая реакция этому препятствует.
При выщелачивании химическая реакция протекает не во всем объеме раствора, а на поверхности твердого тела. Известно, что частицы растворенного в жидкости вещества при ее движении переносятся от точки к точке двояким образом. Во-первых, при разности концентраций возникает молекулярная диффузия и появляется направленный поток вещества из области большей концентрации в область меньшей. Во-вторых, вследствие движения жидкости (конвекции) частицы растворенного вещества увлекаются потоками жидкости и переносятся вместе с ними. Совокупность этих процессов называется конвективной диффузией. Скорость молекулярной диффузии гораздо ниже скорости переноса вещества за счет движения жидкости, поэтому даже при небольшой скорости течения жидкости перенос вещества, обусловленный этим движением, будет преобладать над переносом молекулярной диффузией, и: лишь при очень малой скорости движения жидкости основную роль начинает играть молекулярная диффузия. Из гидродинамики известно, что скорость жидкости, обтекающей твердую поверхность, в непосредственной близости от нее равна нулю, а далее постепенно возрастает и достигает величины, свойственной самому потоку. На рис. 13 показано распределение скоростей движения жидкости вблизи поверхности твердого тела.
За пределами пограничного слоя толщиной 0 скорость потока всюду одинакова и имеет величину V0. На расстоянии, меньшем, чем о, скорость движения жидкости снижается, но остается все же достаточно большой, и перенос вещества осуществляется так же, как и в объеме раствора, главным образом, за счет движения жидкости. И только в непосредственной близости от твердой поверхности находится тонкий слой толщиной д, в котором преобладающая доля вещества переносится молекулярной диффузией. Таким образом, основное сопротивление переносу растворенного вещества оказывает не весь пограничный слой, а только его небольшая часть толщиной, так называемый диффузионный слой. В этом слое происходит основное изменение концентрации диффундирующего вещества. Толщина его тем меньше, чем больше скорость движения жидкости относительно твердого тела и чем меньше коэффициент диффузии и вязкость раствора. В общем случае толщина диффузионного слоя не одинакова в различных точках поверхности, что обусловлено различием в скоростях движения жидкости в различных точках. Так как величина д зависит от коэффициента диффузии вещества, то при одновременной диффузии нескольких веществ для каждого из них характерна своя толщина диффузионного слоя. С практической точки зрения наиболее важной является зависимость д от интенсивности перемешивания (скорости движения жидкости относительно твердого тела).
Согласно первому закону Фика количество вещества, прошедшее в результате молекулярной диффузии через плоскую поверхность, пропорционально величине этой поверхности, продолжительности диффузии и градиенту концентрации по нормали к поверхности:
dm = - DS dф (dC/dx),.
где dm — количество продиффундировавшего реагента, моль;
D — коэффициент диффузии, см2/с;
S — площадь, см2;
dC/dx — градиент концентрации, моль/см4. Отсюда скорость диффузии (поток реагента в единицу времени) равна:
V=- DS (dC/dx), моль/с.
Так как концентрация вещества уменьшается по направлению диффузионного потока, то градиент концентрации имеет отрицательное значение.
Обозначим концентрацию реагента на поверхности твердого тела Сп. а концентрацию в объеме раствора — через С0 Очевидно, что вследствие протекания химической реакции СП<�С0. В первом приближении можно считать, что изменение концентрации в пределах диффузионного слоя носит линейный характер. Поэтому уравнение можно заменить выражением:
V= -DS (Cп-С0)/0
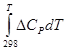
Если скорость химической реакции во много раз больше скорости диффузии реагента, то каждый приближающийся к поверхности твердого тела ион (или молекула) реагента немедленно вступит в химическую реакцию, и концентрация этих ионов у поверхности твердого тела будет намного меньше, чем в объеме раствора, т. е. Сп<�Со. Характер изменения концентрации реагента вблизи поверхности твердого тела в этом случае примет вид, показанный на рис. 14 а. Тогда уравнение скорости диффузии примет вид:
V=DSC0/0
Это уравнение показывает, что при протекании процесса в диффузионной области скорость диффузии реагента к поверхности выщелачиваемого вещества, а, следовательно, и скорость всего процесса выщелачивания возрастает с ростом интенсивности перемешивания (уменьшается величина 0) и концентрации реагента (первый порядок по концентрации реагента).
При отсутствии диффузионных торможений процесс выщелачивания может лимитироваться скоростью химической реакции, протекающей, на поверхности твердого тела. Химическая реакция, являясь одной из стадий гетерогенного процесса, сама в свою очередь протекает через определенные стадии и, следовательно имеет свой собственный механизм. Механизмы химических реакций отличаются большим разнообразием. Очевидно, что для реакций, протекающих на границе раздела фаз, количества прореагировавшего в единицу времени реагента и образовавшегося продукта реакции пропорциональны поверхности раздела фаз. В общем случае скорость химической реакции, протекающей при выщелачивании на границе твердого тела и раствора, может быть описана кинетическим уравнением:
V=KSCnп, где.
V количество прореагировавшего в единицу времени реагента, моль/с;
S — поверхность, на которой протекает реакция, см2;
k — константа скорости реакции;
Сп — концентрация реагента в слое жидкости, непосредственно прилегающем к поверхности твердого тела, моль/см3;
n — порядок реакции.
При протекании процесса в кинетической области медленно идущая химическая реакция не успевает «убирать» ионы (или молекулы) реагента, доставляемые к поверхности твердого тела диффузией. Поэтому концентрации реагента у поверхности твердого тела и в объеме раствора примерно одинаковы: Сп=Со (рис. 14,6). С учетом этого для скорости процесса в кинетической области получим:
V=KSCn0
В это уравнение величина д не входит, т. е. скорость растворения в кинетической области не зависит от условий перемешивания. Видно также, что в кинетическом режиме по сравнению с диффузионным зависимость скорости процесса от концентрации реагента имеет более сложный характер и определяется порядком химической реакции. И только в частном случае при n=1 зависимости скорости от концентрации реагента та же, что и при диффузионном контроле.
При экспериментальном исследовании кинетики того или иного гетерогенного процесса весьма важно бывает установить, протекает ли процесс в данных условиях в кинетическом режиме или диффузионном. Чтобы это сделать, необходимо располагать объективными критериями, которые позволяли бы на основании экспериментальных данных судить о характере стадии, контролирующей скорость всего процесса. Наиболее надежным критерием может служить влияние условий перемешивания на скорость процесса. Так, увеличение скорости процесса с повышением интенсивности перемешивания свидетельствует о том, что процесс протекает в диффузионной области. Напротив, независимость скорости от условий перемешивания указывает на кинетический режим процесса.
Другим критерием протекания гетерогенного процесса в диффузионной или кинетической области может служить характер изменения скорости процесса от температуры. Скорость химической реакции растет с повышением температуры гораздо быстрее скорости диффузии. Количественное влияние температуры на скорость химической реакции выражается уравнением Аррениуса:
K=K0 exp (- E/RT), где, где К— константа скорости химической реакции;
Е — энергия активации химической реакции, Дж/моль;
R — универсальная газовая постоянная,.
R = 8,31 Дж/(моль/К);
Т — абсолютная температура, К;
K0— константа.
Как следует из уравнения, скорость реакции изменяется с температурой тем сильнее, чем больше значение Е. Для большинства химических реакций, протекающих на границе твердое тело — раствор, энергия активации превышает 35—40 кДж/моль.
Подставив это уравнение в выражение скорости, получим зависимость скорости процесса в кинетической области от температуры:
V= K0 SCn0exp (- E/RT).
Скорость диффузионных процессов также возрастает с температурой. Это обусловлено тем, что с повышением температуры уменьшается толщина диффузионного слоя д (вследствие уменьшения кинематической вязкости раствора) и возрастает коэффициент диффузии D. Можно принять, что влияние температуры на скорость диффузии также имеет экспоненциальный характер и описывается уравнением аналогичным. Но поскольку кинематическая вязкость раствора и коэффициент диффузии относительно мало изменяются с температурой, величина кажущейся энергии активации диффузионных процессов имеет небольшое значение, порядка 8—20 кДж/моль.
Для определения Е экспериментально измеряют скорость процесса при нескольких отличающихся температурах (и прочих одинаковых условиях), строят график в координатах lgV—(1/T) и рассчитывают Е, учитывая, что в соответствии с уравнением тангенс угла наклона полученной прямой линии к оси абсцисс равен— (E/2,3RT).
Наряду с характером зависимости скорости процесса от условий перемешивания, значение кажущейся энергии активации Е является другим широко применяемым критерием для установления самой медленной стадии процесса. При этом исходят из того, что небольшие значения Е (8—20 кДж/моль) указывают на протекание процесса в диффузионной области; E>35—40 кДж/моль (обычно равная 40—200 кДж/моль) свидетельствует о кинетическом режиме; промежуточным значениям Е соответствует смешанная область.
Типы аппаратов, применяемых для выщелачивания Назначение аппаратов, используемых для выщелачивания, состоит в том, чтобы обеспечить контакт между раствором и твердым материалом в течение необходимого времени и при оптимальных для выщелачивания условиях. В соответствии с этим аппарат для выщелачивания представляет собой сосуд с устройствами для перемешивания и нагрева пульпы и для ее загрузки и выгрузки.
Распространенный тип аппаратов для выщелачивания — реактор с механической мешалкой и паровой рубашкой или змеевиком для обогрева (см. рис. 15а). Вместо механического перемешивания иногда применяют аэролифтное устройство (см. рис. 15б). В последнее время все большее распространение получают высокопроизводительные аппараты для выщелачивания в кипящем слое (см. рис. 15в).
Для извлечения металлов из руд, легкодоступных выщелачиванию при относительно крупных размерах частиц, допускающих просачивание раствора через значительный слой руды, применяют выщелачивание просачиванием (перколяцию). Схема чана для перколяции приведена на рис. 16а. Процессы, подобные перколяции, происходят в случае кучного (рис. 16б) и подземного (рис. 16в) выщелачивания.
Перечисленные аппараты для выщелачивания несложны по конструкции и просты в эксплуатации. Однако они работают при атмосферном давлении, что ограничивает возможность увеличения скорости выщелачивания путем повышения температуры или давления газообразного реагента. Поэтому довольно широко распространено выщелачивание в герметичных сосудах-автоклавах, например, в производстве глинозема по способу Байера, при разложении шеелитовых концентратов раствором соды, при окислительном выщелачивании сульфидов.
Можно выделить две группы автоклавных процессов. Первая группа — это процессы, подобные разложению бокситов или шеелитовых концентратов, в которых не участвуют газообразные реагенты, и назначение автоклава состоит в том, чтобы обеспечить возможность проведения выщелачивания при температуре выше 1000С Основные преимущества выщелачивания при повышенных температурах: 1) ускорение процесса, обусловленное увеличением скорости химических реакций и скорости диффузии; 2) для эндотермических реакций — сдвиг равновесия в благоприятную сторону, что уменьшает необходимый избыток реагентов.
Ко второй группе автоклавных процессов относятся процессы выщелачивания, протекающие с участием газообразных реагентов. В подобных случаях осуществление процесса в автоклаве позволяет обеспечить более высокую концентрацию газа в растворе.
Зависимость растворимости газов от температуры имеет сложный характер: повышение ее до 100—120°С сопровождается падением растворимости газа, а при дальнейшем увеличении температуры растворимость растет. Поэтому наиболее целесообразно проводить выщелачивание при 200 °C и более, когда обеспечиваются одновременно и высокая растворимость газа, и большая скорость реакций и диффузии.
Типичные конструкции автоклавов приведены на рис. 17. Автоклавы первого типа с обогревом и перемешиванием острым паром широко используют для выщелачивания бокситов (процесс Байера). Автоклавы второго типа часто применяют для окислительного автоклавного выщелачивания с участием кислорода; перемешивающее устройство обеспечивает интенсивную аэрацию пульпы.
Режимы выщелачивания. По характеру загрузки (во времени) твердого вещества и жидкости различают три режима выщелачивания: периодический, полунепрерывный и непрерывный. При периодическом режиме реагирующие вещества (твердая фаза и жидкость) загружают в аппарат единовременно. После определенного времени контакта при перемешивании, необходимого для достижения требуемой степени превращения, продукты реакции выгружают. Периодическое выщелачивание применяют в случае малых масштабов производства. Полунепрерывный режим выщелачивания характеризуется единовременной загрузкой и выгрузкой твердой фазы и непрерывной подачей и выгрузкой жидкой фазы (перколяция, кучное и подземное выщелачивание). При непрерывном режиме осуществляют непрерывную подачу в аппарат (или систему аппаратов) исходных веществ и непрерывную выгрузку продуктов реакции. При этом большей частью используют каскад из последовательно соединенных аппаратов, в которых осуществляется прямоточное или противоточное выщелачивание. При непрерывном прямоточном выщелачивании исходные твердая и жидкая фазы одновременно поступают (обычно в форме пульпы) в первый аппарат, проходят последовательно все аппараты каскада и выгружаются из последнего аппарата.
В случае непрерывного противоточного выщелачивания твердый выщелачиваемый материал и выщелачивающий раствор движутся навстречу один другому. Таким образом, материал, наиболее обедненный извлекаемым компонентом, контактирует со свежим выщелачивающим раствором. С точки зрения кинетики это наиболее рациональный способ, но его осуществление связано с необходимостью разделять фильтрацией твердую и жидкую фазы после каждого аппарата.