Закон джоуля для идеального газа

Сторонникам противоположного (общепринятого) мнения остаётся ссылаться на то, что при предельно низких давлениях опыты провести невозможно, и, следовательно, можно говорить о том, что прямым экспериментом закон Джоуля не опровергнуть. Но, если продолжить эту мысль дальше — то и не доказать. То есть, следуя этой формальной логике, в области предельно низких давлений закон Джоуля свободен… Читать ещё >
Закон джоуля для идеального газа (реферат, курсовая, диплом, контрольная)
(анализ результатов опытов Гей-Люссака и Джоуля) Выведен на основании опытов по адиабатическому расширению газа в пустоту (вакуум). Поскольку в этом процессе расширяющийся газ не преодолевает сопротивление внешних сил (не совершает работу) и не обменивается теплом с внешней средой, то внутренняя энергия газа должна оставаться постоянной. Интерес состоял в том, чтобы узнать: как поведёт себя при этом температура.
Как известно, Джоуль, по существу, продолжил опыты, начатые Гей-Люссаком в 1807 году (см. Л 3). Схема опытной установки Гей-Люссака показана на Рис. 1.

Установка состояла из двух баллонов с теплоизолирующими стенками, ёмкостью по 12 литров каждый, и соединённых между собой свинцовой трубкой; оборудованных запорными кранами (К) и термометрами (Т), с точностью измерения 0,01 градуса Цельсия.
Воздух из баллона 2 предварительно был откачан, в другом баллоне воздух находился под давлением. После того как температура установки выравнивалась с температурой окружающей среды, открывались краны, К и воздух из баллона 1 начинал перетекать в баллон 2. При этом температура воздуха в баллоне 1 понижалась, вследствие выполнения работы по разгону потока воздуха; в баллоне 2, напротив, температура повышалась. После того как давление выравнивалось, и перетечка воздуха прекращалась, величина снижения температуры в одном баллоне равнялась величине её повышения в другом.
На основании этого опыта был сделан ошибочный вывод о том, что при смешении масс воздуха находящихся в баллонах, температура расширенного воздуха останется равной первоначальной.
Долгое время этот поспешный вывод не имел последствий, и, лишь спустя 35 лет, Роберт Майер воспользовался этим выводом для расчёта механического эквивалента теплоты. Расчёты Майера были признаны не вдруг и не сразу. И, всё же, Джоуль, начиная опыты по определения механического эквивалента теплоты и опыты по расширению газов в пустоту, уже знал и вывод Гей-Люссака, и результаты, полученные Майером, что, безусловно, сказалось на оценке результатов экспериментов и самим Джоулем и мировой научной общественностью.
В чём же состояла ошибка Гей-Люссака?
Дело в том, что вывод сделанный им, явно не соответствует результатам его же опытов. Ведь очевидно, что в баллоне 2, где температура воздуха выше, находится меньшее количество (меньшая масса газа), чем в баллоне с более низкой температурой. И поэтому, при смешении объёмов газа, температура смеси будет меньше первоначальной. Это легко увидеть из анализа уравнения газового состояния:
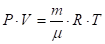
;
Где: Р — давление газа;
V — объём;
m — масса газа;
— масса одного моля газа;
R — газовая постоянная;
Т — температура газа по шкале Кельвина.
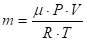
Откуда;
Где:; R — величины постоянные, а Р и V в обоих баллонах равны.
И, следовательно:


;;
Где: — масса воздуха в первом баллоне после расширения;
— масса воздуха во втором баллоне;
— температура воздуха в первом и втором баллонах, соответственно.
То есть, массы газа в баллонах обратно пропорциональны их температурам.

;
Поскольку, то >. При смешении объёмов, тепло от более нагретой массы перейдёт к массе менее нагретой. Можно записать:
;
Где: — тепло полученное газом из первого баллона;
— тепло отданное газом из второго баллона.
;
;
Где:С — теплоёмкость газа. Поскольку она слабо зависит от температуры, её можно считать одинаковой и для 1-го и для 2-го объёмов;
; - массы газов в первом и втором баллонах, соответственно;
— величина изменения (увеличения) температуры газа первого баллона, при смешении объёмов;
— величина изменения (уменьшения) температуры газа второго баллона, при смешении объёмов.
Приравнивая правые части уравнений, получим:
;; или.


;Поскольку,, то ;
Полученное неравенство, как раз, и говорит о том, что при смешении объёмов газа, температура смеси будет ниже первоначальной.
Графически, изменение температуры газа в баллонах, при его расширении и последующем смешении, показано на рис. 2.
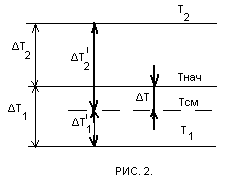
Где:Тнач. — начальная температура газа (воздуха) и всей установки в целом;
Тсм — температура газа после расширения и смешения объёмов;
— температура газа в первом и втором баллонах, после расширения;
— изменение температуры газа в баллонах 1,2, после расширения;
— изменение температуры газов объёмов 1,2, при их смешении;
— величина снижения температуры газа при его расширении и последующем смешении объёмов.
Эффект эксперимента определится из выражения:
=Тнач-Тсм;
Поскольку в данном эксперименте зафиксировано, что, то Тсм можно представить в виде: Тсм=; см. Рис. 2, тогда после подстановки получим:

;(7).
— определится из решения системы уравнений:
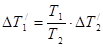
;
;
Из второго уравнения, получим:
;
Подставляя в первое уравнение, найдём:

;
После преобразования, получим:

;
Подставляя выражение в (7) и преобразовывая, окончательно получим:

;(8).
джоуль газ идеальный Рассчитаем конкретный пример, для следующих условий:
Тнач=298о К; К; К Подставляя значения в формулу (8), получим:

;
То есть, если бы при начальной температуре воздуха равной 298оК, после расширения температура воздуха в первом баллоне снизилась бы на 20 градусов, а во втором баллоне повысилась на эту же величину, то это соответствовало бы снижению температуры смеси, относительно начальной температуры, на 1,34 градуса.
Таким образом, опыт Гей-Люссака фактически показал, что при расширении газа в вакуум, его температура уменьшается.
Для пущей убедительности этого утверждения, качественно оценим методические погрешности этого эксперимента, то есть уясним: уменьшают или увеличивают эти погрешности измеряемый эффект понижения температуры газа.
Начальная температура газа в баллоне 1, перед открытием запорных кранов К, температура стенок и изоляции баллонов 1,2, а также температура соединительных трубопроводов и запорных кранов, — равнялись температуре наружного воздуха. Поэтому теплообмен между газом, заключённым в баллоне, и окружающей средой, перед открытием запорных кранов, происходить не мог. После открытия кранов, вследствие уменьшения температуры газа в первом баллоне, начинался переток тепла от стенки баллона к заключённому в нём газу. И, наоборот, вследствие увеличения температуры газа во втором баллоне, начинался переход тепла от газа к стенке баллона. Но эти тепловые потоки уравновешивали друг друга, вследствие равных перепадов температур между газом и стенкой в обоих баллонах.
Однако, наряду с этим, имел место, ничем не скомпенсированный и не учтённый экспериментаторами, переход тепла от стенки соединительного трубопровода, а также от корпусов запорных кранов, к протекающему в них газу вследствие того, что при истечении газа его температура снижается.
Физика этого процесса такова: при ускорении газового потока, часть его внутренней энергии переходит в кинетическую энергию потока, то есть в энергию более организованную и направленную по потоку. При этом, составляющая кинетической энергии молекул газа, перпендикулярная потоку, уменьшается; следовательно, уменьшается и перпендикулярная потоку составляющая давления газа на стенки трубопроводов (то есть, статическое давление), а, следовательно, уменьшается и перпендикулярная потоку составляющая температуры газа (назовём её нормальной температурой, или температурой незаторможенного потока).
Величину этой температуры показал бы термометр, перемещающийся вместе с потоком, но такой способ измерения температуры на практике трудно осуществим. Проще измерить эту температуру термометром, вмонтированным в стенку трубопровода, заподлицо с его внутренней поверхностью. Такой термометр покажет температуру близкую к температуре незаторможенного потока, но несколько большую (за счёт частичного торможения потока возле стенки).
Температура незаторможенного потока существенно отличается от температуры торможения, различие между ними столь же существенно, как и между величинами полного и статического давления.
Итак, как только газ (воздух) потёк по соединительной трубке, его температура (температура незаторможенного потока) опустилась ниже температуры стенки соединительной трубки и ниже температуры запорных кранов, что вызвало переток тепла от стенок трубки и кранов к потоку воздуха.
Величина тепловой энергии, полученной потоком воздуха, зависела от перепада температур между стенкой и потоком воздуха, от коэффициента теплоотдачи от стенки к потоку, а также от теплоёмкости соединительной трубки и запорных кранов. Поскольку соединительная трубка была свинцовой и имела массу большую, чем масса испытуемого воздуха, то теплоёмкость трубки и кранов была весьма велика.
И, в этих условиях, уже не столь важно: имелась внешняя изоляция на трубке и на кранах, или нет, — запаса тепла в них самих было более чем достаточно, чтобы значительно исказить ожидаемый экспериментальный эффект снижения температуры газа.
Нетрудно видеть, что переток тепла к потоку газа уменьшает измеряемый эффект. Но, несмотря на это, как было показано выше, проведённый Гей-Люссаком эксперимент всё же показал снижение температуры, при расширении газа в пустоту.
Этот качественный анализ погрешностей эксперимента ещё более подкрепляет сделанное ранее заключение о том, что в своих выводах Гей-Люссак грубо ошибся.
Джоуль думал иначе и продолжил опыты, начатые Гей-Люссаком, стараясь сделать их более точными и законченными, не требующими вычислений для получения окончательных результатов.
Схема опытной установки Джоуля показана на Рис. 3.

По существу, это схема Гей-Люссака, но помещённая в калориметр, заполненный жидкостью, изменение температуры которой должно было указать на изменение температуры газа, после его расширения и установления теплового равновесия между газом и жидкостью.
Таким образом, Джоуль, как бы, измерил температуру смеси объёмов 1 и 2, не смешивая их. И, кроме того, он исключил погрешность, связанную с переходом тепла от соединительной трубки к потоку газа, при его расширении; ибо, после расширения газа, трубка всё равно приходила в состояние теплового равновесия с жидкостью в калориметре.
Согласно Л1, Л2, Л3 и других источников, в опытах было зафиксировано незначительное изменение температуры жидкости, что было расценено как подтверждение вывода Гей-Люссака о неизменности температуры газа, при его адиабатическом расширении в пустоту, полученное, правда, с какой то незначительной погрешностью.
В современной общедоступной литературе анализа и расчёта величины погрешности опытов Джоуля не делается. Похоже, что и сам Джоуль не делал такого анализа — и напрасно: ведь незначительное изменение температуры жидкости вовсе не означает, что и температура газа изменилась незначительно.
Уже при знакомстве с одной только схемой опытной установки Джоуля, даже не зная её конкретных параметров, из чисто практических соображений, можно заключить, следующее.
Для организации процесса циркуляции жидкости в калориметре, с целью надёжного выравнивания температуры отдельных частей установки, жидкость должна достаточно свободно обтекать баллоны, трубки, краны и не встречать на своём пути значительных сопротивлений. А для этого, объём жидкости должен быть достаточно большим, сравнимым с объёмом занимаемым баллонами с газом.
Как известно, плотность газа на несколько порядков меньше плотности жидкости; соответственно, массовая теплоёмкость жидкости калориметра должна быть на несколько порядков выше массовой теплоёмкости испытываемого газа (воздуха). А потому, изменение температуры жидкости в опытах Джоуля было, очевидно, на несколько порядков меньше величины изменения температуры газа, в опытах Гей-Люссака. То есть, Джоуль уменьшил чувствительность эксперимента на несколько порядков, — вряд ли это можно назвать улучшением схемы Гей-Люссака. Причём, это обстоятельство является решающим и перечёркивает все другие усовершенствования схемы опытной установки.
Подкрепим эту мысль расчётами.
Например, если давление воздуха после его расширения равнялось атмосферному, то плотность воздуха составляла: 1,3 кг/м3; удельная теплоёмкость его, согласно Л5, примерно равнялась 1кДж/кг; а удельная теплоёмкость воды составляла 4,2 кДж/кг, при её плотности 1000 кг/м3.
Если принять, что объём жидкости равен суммарному объёму баллонов, то отношение массовых теплоёмкостей газа и воды будет равно:

;
То есть, если температура смеси воздуха после расширения, в опытах Гей-Люссака, уменьшилась, скажем, на 10 градусов (), то на опытной установке Джоуля, температура воды в калориметре уменьшится всего лишь на градусов.

Где: ;(9) град.
Если учесть, что точность измерения температуры у Гей-Люссака составляла 0,01 градуса и предположить, что точность термометров применяемых Джоулем вряд ли могла быть выше, то совершенно очевидно, что изменение температуры жидкости, на величину градуса Кельвина, достоверно зафиксировать невозможно — ибо ожидаемый эффект опыта в 3-и раза меньше погрешности измерения.
Таким образом, Джоуль, кажется, сделал всё, чтобы подтвердить ошибочный вывод Гей-Люссака о неизменности температуры газа при его расширении; и поэтому вызывает удивление тот факт, что ему, всё же, удалось зафиксировать какое то незначительное изменение температуры жидкости.
Полученный результат не вполне удовлетворил Джоуля, и, для «повышения достоверности» опытов, Джоуль сделал следующий шаг в том же направлении (в направлении уменьшения чувствительности эксперимента). Нетрудно догадаться, что для этого ему надо было уменьшить массовую теплоёмкость исследуемого газа, путём уменьшения первоначального давления в баллоне 1.
Если давление, к примеру, уменьшить в 10 раз, то и измеряемый эффект уменьшится в 10 раз и составит градуса; зафиксировать его будет уже значительно трудней. Если давление уменьшить в 100 раз, то и измеряемый эффект уменьшится в 100 раз, и так далее. Таким образом, при каком то, достаточно низком давлении воздуха, зафиксировать снижение температуры жидкости будет практически невозможно.
Но и такой результат опытов не мог считаться вполне строгим, учитывая, что со временем может появиться более точный термометр. И здесь, «на помощь» физике пришла математика.
Очевидно, что если принять первоначальное давление воздуха в баллоне 1 очень близким к нулю (давление воздуха Р стремится к нулю), то при этом, и массовая теплоёмкость исследуемого воздуха также будет стремиться к нулю — воздух практически исчезает, вырождается. Теплоёмкость же жидкости в калориметре остаётся величиной постоянной, и, поэтому, отношение массовых теплоёмкостей газа и жидкости будет стремиться к нулю; следовательно, будет стремиться к нулю и величина изменения температуры жидкости, в формуле (9).
В этих условиях, любой, самый точный, термометр не сможет зафиксировать изменения температуры жидкости калориметра, даже если температура газа в процессе расширения значительно уменьшится. Ибо газ с нулевой теплоёмкостью не может изменить температуру жидкости с бесконечно большой (относительно этого газа) теплоёмкостью.
Не приняв во внимание, более чем существенное, различие массовых теплоёмкостей жидкости и газа, Джоуль сделал неверный вывод о том, что при давлении газа стремящимся к нулю, температура газа, при его расширении в пустоту без выполнения работы, не изменяется.
Очевидно, что этот ошибочный вывод оказался возможным лишь вследствие нацеленности Джоуля на заранее «известный» результат, при отсутствии критического анализа методики проведения своих экспериментов.
В техническом плане, всё «доказательство» закона Джоуля держится на немыслимо большом снижении чувствительности эксперимента.
Такой эксперимент, по существу, является несостоятельным и изначально (методически) неправильным.
Установка (схема) Джоуля малопригодна для исследования свойств газа. Но если уж пользоваться ею, то надо было начинать опыты с достаточно высоких давлений газа, при которых можно было бы достоверно зафиксировать изменение температуры жидкости калориметра, вследствие расширения газа. Далее, по формуле:
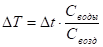
;().
Определить изменение температуры газа, вследствие его расширения.
Проделать серию таких опытов, постепенно снижая первоначальное давление газа до тех пор, пока чувствительность термометров позволяет фиксировать изменение температуры жидкости с достаточной точностью.
А ещё лучше было бы, провести опыты по расширению газов, непосредственно измеряя температуру газа после расширения (то есть, по схеме Гей-Люссака, только несколько улучшенной и позволяющей смешивать объёмы газа после расширения). Это позволило бы достичь более низких давлений газа, при хорошей точности измерения эффекта, снижения температуры газа.
После этого, составить график зависимости от Р, при условии, скажем, расширения газа, во всех этих опытах, вдвое. И затем уже, анализировать этот график и строить предположения относительно того, как будет себя вести величина при Р стремящемся к нулю.
Ничего этого сделано не было.
Но, имеющихся на сегодняшний день общеизвестных опытных фактов вполне достаточно чтобы утверждать, что при нормальном давлении газа и при более высоких давлениях, закон Джоуля не выполняется; и нет никаких оснований считать, что он выполняется при предельно низком давлении газа, при Р стремящимся к нулю.
Сторонникам противоположного (общепринятого) мнения остаётся ссылаться на то, что при предельно низких давлениях опыты провести невозможно, и, следовательно, можно говорить о том, что прямым экспериментом закон Джоуля не опровергнуть. Но, если продолжить эту мысль дальше — то и не доказать. То есть, следуя этой формальной логике, в области предельно низких давлений закон Джоуля свободен (независим) от эксперимента, но тогда это не закон, а просто гипотеза. Кроме того, «спрятавшись» в недостижимую для эксперимента область (область, где давление газа стремится к нулю, т. е. исчезающее малую область) гипотеза Джоуля, с точки зрения здравого смысла, потеряла всякое практическое значение.
Тем не менее, «закон Джоуля» успешно продержался почти два века, несмотря на то, что его «доказательство», как было показано выше, держится фактически на подмене величины изменения температуры газа, величиной изменения температуры жидкости калориметра. Это кажется почти невероятным. Неужели Джоуль не видел этой подмены? Вряд ли, скорее дело в другом: он, видимо, не решился использовать свой здравый смысл экспериментатора в споре с теоретиками-идеалистами, более сведущими в математике и формальной логике.
Альберт Эйнштейн один из тех, кто прекрасно усвоил этот «плодотворный» термодинамический метод доказательства беспочвенных идей и успешно использовал его в дальнейшем, в своих работах по относительности. Метод этот основывается на отрицании здравого смысла и на возвышении теории над опытом. Но лучше всего об этом скажет сам Эйнштейн, вот наиболее одиозные его высказывания, касающиеся метода познания:
«Физика представляет собой развивающуюся логическую систему мышления, основы которой можно получить не выделением их какими либо индуктивными методами из пережитых опытов, а лишь свободным вымыслом»;
«Опыт не может подтвердить существующую теорию, он может лишь её опровергнуть»;
«Ошибаются теоретики, думающие, что теория индуктивно выводится из опыта».
После этих откровений А. Эйнштейна, становится тревожно за будущее науки.
Эйнштейн, безусловно, черпал вдохновение в методе термодинамики, но хорошо хотя бы то, что сам он в термодинамике ничего не успел сделать и не запутал окончательно и без того противоречивый предмет.
Основной проблемой метода термодинамики является то, что не состоятельный (не имеющий опытного обоснования) «закон Джоуля» положен в основание этой науки и, по сути, является вторым началом термодинамики. Первым и основным началом, безусловно, остаётся закон сохранения энергии.
Газ, при давлении стремящимся к нулю, получил название идеального, а закон Джоуля получил статус закона для идеального газа. Похоже на то, что это понятие идеального газа придумано специально, чтобы исключить возможность прямой экспериментальной проверки «закона Джоуля». Такой газ правильней было бы назвать вырожденным, чтобы не путать его с другим понятием идеального газа, согласно которого: идеальным считается газ, строго подчиняющийся уравнению состояния. И это разумная идеализация, ибо этому условию с хорошей точностью (до 0,5%) подчиняются практически все газы, в диапазоне температур и давлений, применяемых в энергетике и в других отраслях техники.
Дав двум различным газам одно и то же определение «идеальный», физики внесли путаницу в науку термодинамику, что позволило несостоятельному «закону Джоуля» исподволь, с молчаливого согласия Джоуля и других корифеев термодинамики, расширить сферу своего применения и на газ, подчиняющийся уравнению состояния. Хотя, при давлениях отличных от нуля, «закон Джоуля» не только не доказан. Но, напротив, доказано экспериментально, что «закон» этот — не выполняется. Об этом недвусмысленно говорят результаты опытов Гей-Люссака, при условии правильного расчёта температуры смешения объёмов газа, после его расширения.