Определение краевого угла смачивания

За титр испытуемой сыворотки принимали последнее разбавление, дающее агглютинацию эритроцитов на два креста («++»). Реакция в контрольных лунках на отсутствие спонтанной агглютинации диагностикума должна была быть отрицательной. Иммунологический планшет оставляли на ровной поверхности при комнатной температуре, исключая его перемещение. Учет результатов РПГА проводили через 2,5−3,5 часа после… Читать ещё >
Определение краевого угла смачивания (реферат, курсовая, диплом, контрольная)
Величину краевого угла смачивания определяли методом лежащей капли. Для этого исследуемый образец полимерной суспензии наносили на поверхность обезжиренного стекла и высушивали при комнатной температуре. Толщина получаемого слоя частиц составляла ~200 мкм. Каплю дистиллированной воды объемом 1 мкл наносили на поверхность исследуемого слоя частиц и фотографировали при увеличении объектива х 4 через 10 сек. с помощью гониометра DSA 15E (EasyDrop) фирмы «Krьss» (Германия). Полученное изображение горизонтальной проекции капли анализировали на компьютере с помощью программного обеспечения DSAv. 1.90.0.14 (Krьss). Форму лежащей капли оценивали по методу Юнга-Лапласа.
Результаты не менее 10 измерений обрабатывали, используя методы математической статистики, в программеMicrosoftOfficeExcel 2010 (Microsoft).
Постановка реакции пассивной геммагглютинации (РПГА) и реакции пассивной латексной агглютинации (РПЛА)
Постановку РПГА и РПЛА при определении специфической актинвости диагностикумов и уровня антител к дифтерийному анатоксину в сыворотках крови человека проводили в планшетах для иммунологических реакций (однократного применения), содержащих 96 U-образных лунок, производства ОАО «Фирма Медполимер» (Россия).
Постановку РПГА осуществляли согласно схеме, представленной на рис. 2.2.12.1.
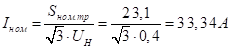
Рис. 2.2.12.1 Схема постановки РПГА и РПЛА.
Эритроцитарный диагностикум разводили до 0,375% концентрации фосфатно-солевым буферным раствором. В каждую лунку вносили по 0,025 мл фосфатно-солевого буферного раствора, содержащего 0,02% Твин 20. В первую лунку вносили 0,025 мл испытуемой сыворотки, разбавленной в требуемое количество раз, и проводили раститровку вплоть до 10 лунки, откуда 0,025 мл раствора удаляли. Вносили в каждую лунку по 0,025 мл разбавленного диагностикума. 11 и 12 лунки служили контролем диагностикумов на отсутствие спонтанной агглютинации.
Иммунологический планшет оставляли на ровной поверхности при комнатной температуре, исключая его перемещение. Учет результатов РПГА проводили через 2,5−3,5 часа после постановки реакции (допускался учет реакции через 18−22 часов).
Учет РПГА проводили визуально по степени агглютинации эритроцитов, которую оценивали по следующей схеме (рис. 2.2.12.2):
" ++++" . | агглютинировавшие частицы носителя ровным слоем выстилают все дно лунки, образуя по форме перевернутый купол; |
" +++" . | в верхней части агглютината отмечается узкое плотное кольцо; |
" ++" . | в верхней части агглютината отмечается более широкое плотное кольцо из частиц носителя, но меньшее по диаметру; |
" +" . | на дне лунки образуется широкое плотное кольцо из частиц носителя с признаками агглютинации по краю осадка; |
" -" . | на дне лунки образуется плотный осадок частиц носителя с полностью гладким краем допускается «выколотый» вариант. |
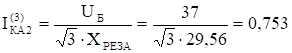
Рис. 2.2.12.2 Результаты РПГА в зависимости от степени агглютинации частиц носителя.
За титр испытуемой сыворотки принимали последнее разбавление, дающее агглютинацию эритроцитов на два креста («++»). Реакция в контрольных лунках на отсутствие спонтанной агглютинации диагностикума должна была быть отрицательной.
Результаты РПГА документировали путем сканирования иммунологического планшета в проходящем свете на сканере 12 000 SPPlusфирмы «Mustek» (США).
Постановку РПЛА осуществляли согласно схеме, представленной на рис. 2.2.12.1.
Латексный диагностикум разводили до 0,2% концентрации фосфатно-солевым буферным раствором. В каждую лунку вносили по 0,050 мл фосфатно-солевого буферного раствора, содержащего 0,02% Твин 20. В первую лунку вносили 0,050 мл испытуемой сыворотки, разбавленной в требуемое количество раз, и проводили раститровку вплоть до 10 лунки, откуда 0,050 мл раствора удаляли. Вносили в каждую лунку по 0,050 мл разбавленного диагностикума. 11 и 12 лунки служили контролем диагностикумов на отсутствие спонтанной агглютинации.
Иммунологический планшет оставляли на ровной поверхности при комнатной температуре, исключая его перемещение. Учет результатов РПЛА проводили через 3−4 часа после постановки реакции (допускался учет реакции через 18−22 часов).
Учет РПЛА проводили визуально по степени агглютинации полимерных частиц, которую оценивали по вышеприведенной схеме (рис. 2.2.12.2).
За титр испытуемой сыворотки принимали последнее разбавление, дающее агглютинацию полимерных частиц на два креста («++»). Реакция в контрольных лунках на отсутствие спонтанной агглютинации диагностикума должна была быть отрицательной.
Результаты РПГА документировали путем сканирования иммунологического планшета в проходящем свете на сканере 12 000 SPPlusфирмы «Mustek» (США).