Хирургическое лечение.
Варикозная болезнь

Паховый (1) и надпаховый (2) доступы к приустьевому отделу большой подкожной вены О необходимости более широкого использования пахового и надпахового доступов свидетельствует то, что повреждение наружной половой артерии, перекидывающейся через ствол большой подкожной вены на 2−3 см дистальнее овальной ямки, почти неизбежно при выполнении косопродольного доступа к сафенофеморальному соустью… Читать ещё >
Хирургическое лечение. Варикозная болезнь (реферат, курсовая, диплом, контрольная)
Хирургическое пособие безусловно является наиболее радикальным способом лечения варикозной болезни. Многовековая история флебологии свидетельствует о превалировании хирургического подхода в лечении данного заболевания. Действительно, только удаленная вена никогда не может расшириться вновь. Стремление многих поколений флебологов добиться идеального сочетания радикальности и минимальной травматичности оперативного вмешательства выразилось в разработке огромного количества способов хирургического лечения. Многие из них в настоящее время оставлены, в то время как ряд методик и технических приемов широко используется во всем мире.
Основная задача оперативного лечения варикозной болезни — устранение патологического рефлюкса и варикозного расширения подкожных вен.
Устранение рефлюкса Вертикальный рефлюкс представляет собой патологический ток крови из глубоких вен в поверхностные (большую и малую подкожные вены) через сафенофеморальное и сафеноподколенное соустья и далее в ретроградном направлении на различном протяжении в зависимости от количества несостоятельных клапанов подкожных вен. При варикозной болезни вертикальный рефлюкс может возникнуть и в глубоких венах вследствие относительной несостоятельности их клапанов.
Сафенофеморальный рефлюкс. Впервые лигирование большой подкожной вены предложил и выполнил в 1888 г. А. А. Троянов. Двумя годами позже о подобном вмешательстве сообщил Ф. Тренделенбург (1890). Оба хирурга предлагали выполнять перевязку вены в верхней трети бедра (на 8−10 см дистальнее сафенофеморального соустья), и лишь в 1912 г. отечественный хирург М. М. Дитерихс модифицировал это вмешательство, произведя приустьевое лигирование большой подкожной вены со всеми притоками. В этом объеме указанный метод стал известен как операция Троянова-Тренделенбурга. В настоящее время вмешательство включает в себя обязательную перевязку и отсечение большой подкожной вены тотчас у места впадения в бедренную вену с одновременным пересечением всех притоков, впадающих в эту область. В специальной литературе высокая приустьевая резекция большой подкожной вены со всеми притоками получила название «кроссэктомия». Это вмешательство является одним из ключевых моментов комбинированной операции при варикозной болезни. Очень важно выполнить его правильно: не повредив бедренных сосудов и не оставив неустраненным сброс через сафенофеморальное соустье. Сохранение ствола большой подкожной вены не избавит пациента от заболевания, а оставление длинной ее культи чревато развитием тромбоза и легочной эмболии в ближайшем послеоперационном периоде и рецидивом заболевания — в отдаленном.
До начала 90-х годов оптимальным для выделения сафенофеморального соустья считался косопродольный доступ, предложенный И. В. Червяковым в 1962 г. Он выполняется по биссектрисе угла, образованного паховой связкой и бедренной артерией. Его очевидными достоинствами являются совпадение проекции кожного разреза с ходом большой подкожной вены и возможность при необходимости экспозиции магистральных сосудов бедра. В то же время у 15% пациентов после косопродольного разреза формируется гипертрофический рубец. Еще одной негативной стороной этого доступа является то, что в его проекции находится наиболее крупный паховый лимфатический узел Розенмюллера-Пирогова, повреждение которого при мобилизации большой подкожной вены у 8−12% пациентов осложняется стойкой послеоперационной лимфореей или образованием лимфоцеле, требующего повторного хирургического вмешательства.
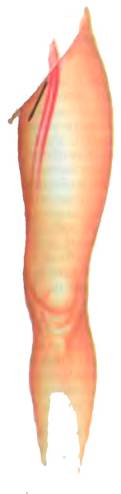
Доступ Червякова к приустьевому отделу большой подкожной вены Указанные недостатки не свойственны паховому и надпаховому доступам к устью большой подкожной вены. При проведении кроссэктомии через паховый операционный доступ, выполняемый точно по одноименной кожной складке, выделение сафенофеморального соустья не вызывает особых затруднений даже у тучных пациентов. Это объясняется особенностью строения жирового слоя на нижних конечностях, где жировая ткань развивается в основном на бедрах, а не в паховой области.
Паховый (1) и надпаховый (2) доступы к приустьевому отделу большой подкожной вены О необходимости более широкого использования пахового и надпахового доступов свидетельствует то, что повреждение наружной половой артерии, перекидывающейся через ствол большой подкожной вены на 2−3 см дистальнее овальной ямки, почти неизбежно при выполнении косопродольного доступа к сафенофеморальному соустью. В результате этого снижается заполнение кровью кавернозных тел, что может способствовать развитию эректильной импотенции у мужчин. Наш опыт показывает, что пересечения этого артериального ствола легче избежать при мобилизации устья большой подкожной вены со стороны его верхней полуокружности, т. е. через паховый или надпаховый доступы. Очевидны и косметические их преимущества, обусловленные локализацией разреза в зоне роста волос, которые полностью маскируют незначительные косметические дефекты. В то же время для выполнения этих доступов у хирурга должен быть достаточный опыт флебохирургии, поскольку очень легко принять наружную подвздошную вену за расширенную большую подкожную вену. Чтобы ошибочно ее не пересечь, требуется особая осторожность.
Очевидна необходимость использования надпахового доступа при рецидивах варикозной болезни, обусловленных наличием длинной культи большой подкожной вены. Верхний приток, сохраняющийся у подавляющего большинства пациентов с патологической культей большой подкожной вены, является надежным ориентиром в поисках сафенофеморального соустья, скрытого в рубцовых тканях. Кроме того, в верхней полуокружности овальной ямки менее выражен рубцовый процесс, и мобилизация культи большой подкожной вены выполняется легче.
Одним из направлений в ликвидации сафенофеморального рефлюкса является пластика несостоятельного остиального клапана. Наибольшее распространение получили экстравазальные методы, при которых предусматривается сужение приустьевого отдела большой подкожной вены. В качестве экстравазального каркаса чаще всего используют фрагменты протезов из политетрафторэтилена или участки удаленных варикозных вен. А. Н. Веденский предлагает проводить коррекцию остиального клапана большой подкожной вены лавсановой спиралью.
Не менее интересным представляется сообщение J. van Cleef (1995) об интравазальной имплантации под ангиографическим контролем пружинного устройства, растягивающего приустьевой отдел большой подкожной вены по линиям крепления створок остиального клапана, что устраняет его относительную недостаточность.
В то же время целесообразность подобных вмешательств представляется весьма сомнительной. Основным аргументом их сторонников служит необходимость сохранения венозных сегментов для возможного в будущем аортокоронарного шунтирования. Вместе с тем для артериальных реконструкций предпочтительны сегменты подкожных вен, расположенные на голени. Предотвратить их варикозную трансформацию можно только ликвидацией низкого вено-венозного сброса или постоянной эластической компрессией, но не пластикой остиального клапана.
Сафенопоплитеальный рефлюкс. Клапанная недостаточность малой подкожной вены выявляется примерно у 11% больных варикозной болезнью. Относительно низкая частота ее поражения связана с анатомическими особенностями строения сосуда. Малая подкожная вена на значительном протяжении располагается под достаточно плотным листком собственной фасции голени. Неприкрытыми остаются только начальный и приустьевый (в этой зоне подколенный апоневроз истончается и утрачивает свою каркасную функцию) отделы этого сосуда.
Вмешательство на приустьевом отделе малой подкожной вены проводят в положении пациента лежа на животе. Стандартный доступ к терминальному отделу малой подкожной вены — поперечный разрез в подколенной области по линии подколенного сгиба. Место расположения разреза целесообразно определять у каждого конкретного пациента с помощью ультразвукового дуплексного сканирования. В 30% случаев терминальный отдел малой подкожной вены располагается на бедре. Иногда кожный разрез приходится выполнять на 8−10 см проксимальнее коленного сгиба.
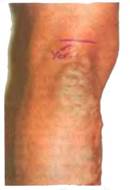
Рецидив варикозной болезни в бассейне малой подкожной вены Проекция расположения сафеноподколенного соустья в нижней трети бедра маркирована перед операцией После рассечения кожи и подкожной жировой клетчатки обнажают тонкую белесоватую фасциальную пластинку — поверхностный листок собственной фасции голени. Обычно под ней просвечивает малая подкожная вена. В этой зоне выполняют продольный (по волокнам фасции) разрез, и после фиксации ее зажимом тупым и острым путем выделяют ее до слияния с подколенной веной. Чаще всего в терминальном отделе малой подкожной вены имеется бифуркация, образованная двумя ветвями, одна из которых направляется непосредственно к подколенной вене, другая (вена Джиакомини) идет вверх и медиально к большой подкожной вене. Необходимо также помнить, что перед впадением в подколенную вену малая подкожная может сливаться с суральными венами, представленными одним или двумя стволами.
Глубокий венозный рефлюкс. Его значение в генезе варикозной болезни часто преувеличивают. Он встречается не более чем у 15% больных. Необходимость вмешательства на глубоких венах при этом заболевании пока не имеет твердых доказательств. Методы, предлагаемые для хирургической коррекции клапанной недостаточности глубоких вен, можно разделить на интравазальные и экстравазальные. Наибольшее распространение в нашей стране получили последние методики. Каркас, суживающий просвет вены в проекции несостоятельного клапана, предлагали создавать из циркулярной лавсановой манжеты, ленты, выкроенной из аутовены, трех циркулярных лигатур, накладываемых на стенку вены на уровне створок, а также выше и ниже клапана. Все эти методы не вышли за рамки клинических экспериментов, тогда как имплантация пластикового спирального корректора, предложенного в 1978 г. А. Н. Веденским, завоевала в нашей стране очень большую популярность.
Операцию выполняют следующим образом. В верхней трети бедра в проекции пульсации бедренной артерии проводят разрез от паховой складки на 6−7 см вниз. Пересекают и перевязывают в приустьевом отделе большую подкожную вену. Затем выделяют бедренную вену в месте впадения глубокой вены бедра и поверхностную бедренную на несколько сантиметров дистальнее их слияния, где чаще всего расположен клапан. На сосуд накладывают турникеты, а ту его зону, куда будет имплантирован корректор, освобождают от крови. После этого «накручивают» спираль, равномерно распределяют ее по вене и фиксируют первый и последний витки нитью 6−0 на атравматической игле к стенке вены. Диаметр корректора должен быть на 1/3 меньше, чем исходный просвет бедренной вены.
Варианты строения бедренной вены нередко обусловливают невозможность эффективной имплантации эластической каркасной спирали. Наиболее частой причиной является локализация створок недостаточного клапана в непосредственной близости от устья глубокой вены бедра. Нередко поводом для отказа от экстравазальной вальвулопластики служит наличие крупных притоков в зоне клапана, что делает невозможным имплантацию спирали. В ряде случаев даже при сужении просвета бедренной вены на 1/3 диаметра не удается восстановить нормальную функцию клапана, поскольку, по-видимому, имеются глубокие дегенеративные изменения его створок.
Среди методов интравазальной вальвулопластики наиболее известен способ Кистнера. Автор предложил устранять провисание одной или обеих клапанных створок (обусловливающее патологический рефлюкс крови) путем пришивания избытка края створки к стенке вены после вскрытия бедренной вены продольным разрезом через одну из комиссур. В последующем были разработаны модификации этого метода, отличающиеся прежде всего направлением флеботомии.
В настоящее время в широкой клинической практике различные методики коррекции клапанов используются крайне редко. Одна из основных причин этого — применение ультразвукового дуплексного ангиосканирования для диагностики венозного рефлюкса, что позволило исключить гипердиагностику клапанной несостоятельности. Так, согласно данным различных исследователей, при ультразвуковом сканировании клапанная недостаточность бедренной и подколенной вен встречается не более чем у 15% пациентов, тогда как в эпоху рентгенофлебографии эта патология диагностировалась более чем у 80% больных варикозной болезнью.
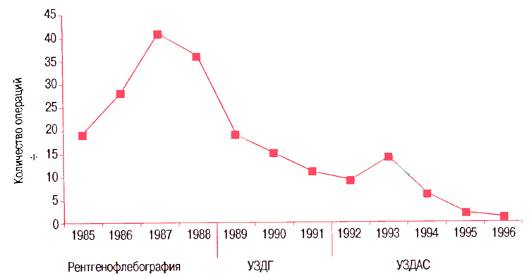
Частота коррекций клапанов бедренной вены в зависимости от превалирующего метода обследования.
(УЗДГ — ультразвуковая допплерография; УЗДАС — ультразвуковое дуплексное ангиосканирование) Вторым и не менее веским основанием для постепенного отказа от вмешательств на глубоких венах стала неудовлетворенность получаемым клиническим эффектом. Например, в клинике факультетской хирургии ргму в 80-е годы было выполнено более 250 имплантаций пластикового корректора А. Н. Веденского. При контрольном осмотре 33 случайно отобранных пациентов в сроки от 10 до 17 лет после операции рефлюкс по бедренной вене через корригированный клапан сохранялся в 42% случаев. При этом не было выявлено зависимости между отсутствием либо наличием рефлюкса и результатами оперативного вмешательства. Неудовлетворенность отдаленными результатами коррекции клапанов глубоких вен отмечают и многие зарубежные исследователи. В целом можно сказать, что эпоха безудержного оптимизма, когда казалось, что хирургические вмешательства на глубоких венах могут радикально решить проблему варикозной болезни, сменилась периодом рационального пессимизма. На международных флебологических форумах (Лондон, 1995; Сидней, 1998; Бремен, 1999) активно обсуждался вопрос о необходимости тщательного изучения отдаленных результатов подобных вмешательств и особенно определения роли недостаточности клапанов глубоких вен в патогенезе варикозной болезни.
Важное значение имеет вопрос о роли клапанной недостаточности задних большеберцовых вен и необходимости ее коррекции при варикозной болезни. В 1988 г. А. Н. Веденский предложил проводить эндовазальную обтурацию этих сосудов. Его методика нашла в нашей стране достаточно много сторонников, которые применяли эту операцию прежде всего в стадии трофических расстройств варикозной болезни. Между тем до сих пор среди флебологов нет единого мнения о том, развивается ли вообще при варикозной болезни несостоятельность клапанов глубоких вен голени. Как уже упоминалось, ведущие флебологи считают такие случаи казуистическими, хотя ряд специалистов указывают на то, что клапанная несостоятельность задних большеберцовых вен встречается с частотой 45−48,4%. Мнение первых исследователей основано на данных ультразвукового ангиосканирования, а вторых — на результатах дистальной восходящей рентгенофлебографии. Отсутствие согласия в отношении проблемы клапанной недостаточности заднеберцовых вен, а также возможность неконтролируемого распространения вторичного тромбоза не позволяют рекомендовать использование методов их обтурации в клинической практике.
В настоящее время ведущие флебологи считают, что различные методы коррекции клапанной недостаточности глубоких вен применять в широкой хирургической практике нецелесообразно, по крайней мере до тех пор, пока не будет разработан малотравматичный и технически несложный способ устранения глубокого венозного рефлюкса, а также доказан хороший лечебный результат в отдаленные сроки.
Суральный рефлюкс. Суральные вены (vv. gastrocnemii) впервые подробно описаны Н. Dodd и F.В. Cockett в 1976 г. Суральноподколенное соустье располагается на уровне суставной щели и локализация его достаточно постоянна. Первое предположение о возможной патогенетической роли сурального рефлюкса высказал J. Hobbs в 1991 г. Тогда же S. Dart обнаружил у 71% пациентов с рецидивом варикозной болезни в системе малой подкожной вены клапанную недостаточность суральных вен. Однако проблема хирургической коррекции этой патологии еще ждет своего разрешения. Так, J. Bergan считает необходимым лигирование этих вен при сочетании рефлюкса по ним с несостоятельностью малой подкожной вены.
Техника операции заключается в следующем. Из поперечного доступа в подколенной ямке после лигирования и пересечения малой подкожной вены в глубине операционной раны выделяют суральнопоплитеальное соустье. Во всех наших наблюдениях суральные вены впадали в подколенную вену общим стволом. При этом отмечался склероз стенок, характерный для варикозной трансформации. Затем в области устья vv. gastrocnemii приподнимают на держалках и отделяют их от передней стенки подколенной вены тупым и острым путем, после чего пересекают. Их проксимальный отрезок дважды с прошиванием лигируют пристеночно к подколенной вене, а дистальную часть просто перевязывают. Контрольная ультрасонография в послеоперационном периоде подтвердила ликвидацию сурального рефлюкса. При динамическом наблюдении в сроки до 1,5 лет у всех пациентов зафиксировано исчезновение судорог в икроножных мышцах.
Полученные нами результаты нашли подтверждение в работах ряда зарубежных исследователей, но все же небольшой опыт хирургических вмешательств и отсутствие достаточного числа наблюдений в отдаленном периоде не позволяют пока рекомендовать проведение операций при изолированной недостаточности vv. gastrocnemii.
Горизонтальный рефлюкс. Устранение этой формы патологического кровотока предусматривает перевязку и пересечение несостоятельных перфорантов, что может быть осуществлено надфасциальным (по Коккету) или подфасциальным (по Линтону) способом. В настоящее время эти вмешательства существенно отличаются от предложенных самими авторами вариантов, хотя «исторические» названия операций остаются общепризнанными.
Надфасциальную перевязку несостоятельных перфорантов осуществляют через небольшие (2 см) разрезы в зоне их клинического или ультразвукового обнаружения. Ключевым моментом вмешательства является выделение перфоранта до места его прохождения под собственную фасцию голени. Только увидев дефект фасции, через который проходит сосуд, можно точно сказать, что это перфорантная вена. Нередко подкожная вена, уходящая вглубь, создает ложное впечатление, что это — перфорант, в то время как при ее тщательном выделении оказывается, что вена резко меняет свой ход и целиком располагается над апоневрозом. Поиски перфорантов в подкожной клетчатке при выраженных изменениях трофики тканей голени сопряжены с опасностью послеоперационного нагноения раны и некроза отслоенной от апоневроза кожи. Поэтому в таких условиях долгое время операцией выбора была субапоневротическая перевязка перфорантных вен по Линтону. Оптимальным для проведения такой операции является оперативный доступ Фельдера в модификации В. С. Савельева и Г. Д. Константиновой, при котором линия разреза проходит по задней поверхности голени на 2−4 см медиальнее средней линии, начиная от границы верхней и средней трети голени и вниз до ахиллова сухожилия. В этом месте следует изменить направление разреза с тем, чтобы он прошел позади медиальной лодыжки и обогнул ее снизу. Тупым и острым путем в обе стороны отслаивают апоневроз от подлежащих мышц, выделяя, пересекая и перевязывая перфорантные вены с клапанной недостаточностью.
В настоящее время при варикозной болезни, протекающей с трофическими расстройствами, ведущую роль играет эндоскопическая диссекция перфорантных вен. Такое вмешательство может быть выполнено как при открытых трофических язвах, являющихся противопоказанием к традиционным методам хирургического лечения, так и при вторичных нарушениях лимфатического оттока. Проведение вмешательства под фасцией вне зоны лимфатических сосудов предохраняет их от дополнительной травмы, а декомпрессия подкожных вен благодаря устранению вено-венозного рефлюкса и редукции подкожной флебогипертензии создает оптимальные условия для разрешения отека.
В зависимости от локализации несостоятельных перфорантных вен следует использовать медиальный или заднемедиальный доступы, выполняемые на 2−3 см проксимальнее зоны трофических расстройств. Медиальный доступ предназначен для пересечения внутренней и частично задней группы перфорантных вен. Заднемедиальный доступ, разработанный А. И. Кириенко и соавт., оптимален при выполнении субтотальной диссекции перфорантных вен, показанной при циркулярных трофических нарушениях или мультиперфорантном венозном сбросе.
Длина кожного разреза обычно составляет 3−4 см. Она зависит от выраженности индурации тканей и выбирается с учетом свободы маневра операционным эндоскопом. После рассечения кожи, подкожной клетчатки и собственной фасции голени последнюю осторожно отслаивают от подлежащих мышц препаровочным тупфером или пальцем на 2−3 см от операционной раны. Если перфорантные вены располагаются в этих пределах, то их пересечение и лигирование выполняют на зажиме или диссекторе. Затем в субфасциальное пространство проводят операционный эндоскоп. Начиная с этого этапа все манипуляции в субфасциальном пространстве осуществляют под видеоконтролем. Перфорантные вены отделяют от окружающих тканей с помощью препаровочного крючка и диссектора. Затем ствол перфорантной вены захватывают в биполярные коагуляционные щипцы и пережигают. Использование режима биполярной коагуляции позволяет облитерировать ствол перфорантной вены диаметром 5−6 мм.
Определенной альтернативой традиционным и эндоскопическим операциям является деструкция перфорантных вен под ультразвуковым контролем. J. van Cleef предлагает выполнять эту процедуру через миниразрез (1−2 мм) с помощью инструментов для минифлебэктомии. А. Г. Кайдорин (1998) предложил выполнять коагуляцию перфорантных вен диаметром до 10 мм с несостоятельными клапанами, пунктируя сосуд специальным устройством, соединенным с диатермокоагулятором. Вместе с тем при таком диаметре перфорантных вен требуется достаточно длительное воздействие, что может привести к коагуляционному некрозу соседних структур, в том числе и глубоких вен. Отрицательной чертой вышеуказанных способов представляется также необходимость использования дорогостоящего ультразвукового оборудования, которое должно быть стерилизовано перед операцией.
В 90-е годы появились сообщения о возможности чрескожной эмболизации перфорантных вен с клапанной недостаточностью. В 1995 г. J. Garcarek и соавт. сообщили об опыте имплантации спирали Gianturco-Wallace в такие перфорантные вены у 7 пациентов с трофическими язвами. Имплантацию осуществляли под рентгенофлебографическим контролем после пункции одной из поверхностных вен. Показанием к проведению подобной манипуляции авторы считают наличие трофических язв у пациентов, которым противопоказано оперативное лечение (возраст, тяжелая соматическая патология, ожирение). В 1999 г. R.A. Lacour и соавт. описали опыт аналогичных вмешательств уже у 46 больных с трофическими расстройствами. Они имплантировали аналогичную спираль во время операции, которая включала в себя также удаление большой подкожной вены на бедре. В 36 случаях авторы окклюзировали одну перфорантную вену в зоне Коккетта, в 10 наблюдениях — 2. В работе особо подчеркивалось, что эмболизация перфорантных вен под ангиографическим контролем должна выполняться по строгим показаниям, поскольку в большинстве случаев поперечная флотация крови может быть успешно устранена с помощью операционной эндоскопии.