Свойства разбавленных растворов
Первый закон Коновалова (применим как для идеальных, так и для отклоняющихся от закона Рауля растворов): насыщенный пар над равновесным ему раствором из двух жидкостей относительно богаче тем компонентом, добавление которого к системе повышает общее давление пара (или снижает температуру кипения). Поэтому при испарении раствора пар обогащен более летучим компонентом, а жидкость — менее летучим… Читать ещё >
Свойства разбавленных растворов (реферат, курсовая, диплом, контрольная)
Раствором называют гомогенную систему, состоящую из нескольких компонентов, т. е. образованную из двух или более индивидуальных веществ. По определению Гиббса: раствор — это фаза переменного состава. Условно состав раствора подразделяют на растворитель (компонент, присутствующий в системе в относительно большем количестве) и растворенное вещество (другие компоненты). Раствор будет идеальным, если образование его не сопровождается уменьшением или увеличением его объема, а также выделением или поглощением тепла. Идеальные растворы подчиняются закону Рауля (см. ниже) при всех концентрациях и всех температурах. Реальные растворы в связи с явлениями ассоциации, диссоциации, сольватации и др. не обладают упомянутыми выше свойствами. Но в состоянии сильного разбавления, а также, если они образованы сходными по химическому составу и физическим свойствам веществами, приближаются к идеальным, поэтому, к ним можно с некоторым приближением применять количественные закономерности, описывающие состояние идеальных растворов. физический химический фазовый газ раствор Здесь рассматриваются только растворы, в которых растворителем является жидкость (чаще всего вода), а растворенными веществами — газы, жидкости или твердые вещества. Состав раствора характеризуется количеством растворенного вещества (веществ) в единице количества раствора или растворителя.
Осмос — самопроизвольное движение молекул растворителя через полупроницаемую мембрану, разделяющую растворы разной концентрации, из раствора меньшей концентрации в раствор с более высокой концентрацией, что приводит к разбавлению последнего. В качестве полупроницаемой мембраны, через маленькие отверстия которой могут селективно проходить только небольшие по объему молекулы растворителя и задерживаются крупные или сольватированные молекулы или ионы, часто служит целлофановая пленка — для высокомолекулярных веществ, а для низкомолекулярных — пленка из ферроцианида меди. Процесс переноса растворителя (осмос) можно предотвратить, если на раствор с большей концентрацией оказать внешнее гидростатическое давление (в условиях равновесия это будет так называемое осмотическое давление, обозначаемое буквой). Для расчета значения в растворах неэлектролитов используется эмпирическое уравнение Вант-Гоффа:
= C R T, (4.1).
где С — молярная концентрация вещества, моль/кг;
R — универсальная газовая постоянная, Дж/моль · К.
Величина осмотического давления пропорциональна числу молекул (в общем случае числу частиц) одного или нескольких веществ, растворенных в данном объеме раствора, и не зависит от их природы и природы растворителя. В растворах сильных или слабых электролитов общее число индивидуальных частиц увеличивается вследствие диссоциации молекул, поэтому в уравнение для расчета осмотического давления необходимо вводить соответствующий коэффициент пропорциональности, называемый изотоническим коэффициентом.
= i C R T, (4.2).
где i — изотонический коэффициент, рассчитываемый как отношение суммы чисел ионов и непродиссоциировавших молекул электролита к начальному числу молекул этого вещества.
Так, если степень диссоциации электролита, т. е. отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества, равна и молекула электролита распадается при этом на n ионов, то изотонический коэффициент рассчитывается следующим образом:
i = 1 + (n — 1), (i > 1). (4.3).
Для сильных электролитов можно принять = 1, тогда i = n, и коэффициент i (также больше 1) носит название осмотического коэффициента.
Явление осмоса имеет большое значение для растительных и животных организмов, поскольку оболочки их клеток по отношению к растворам многих веществ обладают свойствами полупроницаемой мембраны. В чистой воде клетка сильно набухает, в ряде случаев вплоть до разрыва оболочки, а в растворах с высокой концентрацией солей, наоборот, уменьшается в размерах и сморщивается из-за большой потери воды. Поэтому при консервировании пищевых продуктов к ним добавляется большое количество соли или сахара. Клетки микроорганизмов в таких условиях теряют значительное количество воды и гибнут.
Осмотическое давление обеспечивает движение воды в растениях за счет различия осмотических давлений между клеточным соком корней растений (5−20 бар) и почвенным раствором, дополнительно разбавляемом при поливе. Осмотическое давление обусловливает в растении подъем воды от корней до вершины. Таким образом, клетки листьев, теряя воду, осмотически всасывают ее из клеток стебля, а последние берут ее из клеток корня.
Растворимость газов в жидкостях изменяется в широких пределах и зависит не только от природы газа и растворителя, но и от давления и температуры. Количество растворенного газа пропорционально давлению его паров над раствором (закон Генри). Растворимость газов уменьшается при увеличении температуры и присутствии в растворе других веществ.
Равновесие между жидкостью и паром является динамическим — между ними происходит непрерывный обмен молекулами (частицами), причем количество этих молекул, проходящих через единицу поверхности раздела обеих фаз в условиях равновесия, одинаково (в обоих направлениях).
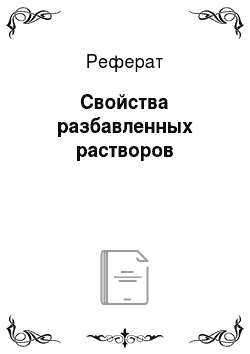
Согласно закону Рауля относительное понижение давления пара растворителя (А) над раствором? зависит только от мольной доли растворенного в жидкости вещества (В), то есть определяется числом частиц вещества В в единице объема, но не зависит от свойств растворенного вещества:
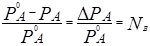
(4.4).
где NВ — мольная доля вещества В в растворе, определяемая по формуле.
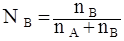
(4.5).
где n — количество моль вещества;

— давление насыщенного пара над чистым растворителем;
РА — давление пара растворителя над раствором (при той же температуре).
Закон Рауля выполняется для идеальных и сильно разбавленных растворов.
РА = (при Т = const), (4.6).
где NA — мольная доля вещества, А в растворе, определяемая по формуле.

. (4.7).
Приведенное уравнение (4.6) показывает, что давление пара растворителя над реальным раствором прямо пропорционально мольной доле растворителя в этом растворе.
При решении задач, связанных с испарением конденсированной фазы чистого вещества, можно использовать следующее уравнение:
(4.8).

где Р1 и Р2 — давление паров при абсолютных температурах Т1 и Т2 соответственно;
— мольная теплота испарения (парообразования), считающаяся постоянной в данном температурном интервале;
R — универсальная газовая постоянная.
Жидкость кипит при той температуре, при которой давление насыщенного пара над ней достигает внешнего давления. С ростом в ней концентрации растворенного нелетучего вещества давление пара растворителя над раствором понижается и раствор кипит при более высокой температуре, чем чистый растворитель. Повышение (изменение) температуры кипения от Т0 для чистого растворителя до Т для разбавленных растворов рассчитывают с помощью следующего уравнения:
Ткип = Т — То = Кэ· Сm, в, (4.9).
где Ткип — повышение температуры кипения раствора, К;
Кэ — эбулиоскопический коэффициент, К · кг · моль- 1;
Сm, В — моляльная концентрация вещества В, моль/кг.
Из уравнения (4.9) видно, что DКэ= Ткип. при Сm, В= 1 моль/ кг. Повышение температуры кипения зависит от концентрации раствора, т. е. от числа частиц в единице объема, но не зависит от типа и свойств этих частиц.
Эбулиоскопический коэффициент зависит только от природы растворителя и определяется следующим образом:
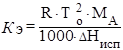
(4.10).
где МА — молярная масса растворителя; г/моль;
Нисп — мольная теплота испарения чистого растворителя.
Поскольку.

(4.11).
где m B — масса растворенного вещества В, г;
М В — молярная масса растворенного вещества В, г/моль;
m A — масса растворителя, г, то уравнение (4.9) с учетом уравнения (4.11) можно записать:
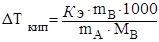
. (4.12).
Полученное уравнение (4.12) можно использовать для определения неизвестной молярной массы растворенного вещества В по экспериментально найденному значению Ткип.
Для расчетов повышения температуры кипения растворов слабых или сильных электролитов необходимо использовать понятие об изотоническом коэффициенте i, приведенном в разделе об осмотическом давлении (см. уравнение 4.3). Тогда уравнение (4.9) принимает следующий вид:
Ткип = КЭ · i · Сm, В. (4.13).
Растворы замерзают при более низкой температуре, чем чистый растворитель, что является следствием понижения давления пара растворителя над раствором. Для разбавленных растворов понижение температуры замерзания от Т0 для чистого растворителя до Т для раствора зависит от количественного состава раствора:
Тзам = Т0 — Т = Кк · Сm, В,(4.14).
где Тзам — понижение температуры замерзания раствора, К;
Кк — криоскопический коэффициент, К кг моль- 1;
Сm, В — моляльная концентрация вещества В, моль/кг.
Из уравнения (4.14) следует, что Тзам = Кк при Сm, В = 1 моль/кг и понижение температуры замерзания раствора определяется только числом частиц в единице его объема, но не зависит от природы этих частиц.
Значение Кк можно рассчитать по формуле:
(4.15).

где МА — молярная масса растворителя А, г/моль;
Н пл — мольная теплота плавления чистого растворителя.
Если в массе растворителя mА находится масса растворенного вещества В, то.
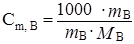
(4.16).
где m B — масса растворенного вещества В, г;
М В — молярная масса растворенного вещества В, г/моль;
m A — масса растворителя, г.
Тогда уравнение (4.14) можно записать:
(4.17).

Уравнение (4.17) можно использовать при экспериментальном определении и расчете молярной массы неизвестного вещества по понижению температуры замерзания его раствора в известном растворителе.
Если растворенное вещество распадается в растворе на ионы, то увеличение числа частиц за счет диссоциации его молекул учитывается через введение изотонического коэффициента i (см. уравнение 4.3):
Т зам = Кк · i · Сm, В. (4.18).
Пример. Водный раствор спирта, содержащий 0,17 г спирта и 20 г воды, замерзает при температуре — 0,354 0С. Рассчитать молярную массу спирта, если криоскопический коэффициент для воды равен 1,86о С кг моль-1.
Решение Для решения воспользуемся уравнением (1.60):
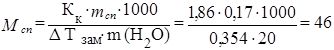
г/моль.
Ответ. М сп = 46 г/моль.
Первый закон Коновалова (применим как для идеальных, так и для отклоняющихся от закона Рауля растворов): насыщенный пар над равновесным ему раствором из двух жидкостей относительно богаче тем компонентом, добавление которого к системе повышает общее давление пара (или снижает температуру кипения). Поэтому при испарении раствора пар обогащен более летучим компонентом, а жидкость — менее летучим. На различиях в составах раствора и равновесного с ним пара основан метод разделения смесей (в основном органических жидкостей) путем ректификации. Повторяя операции испарения — конденсации, можно получить чистые компоненты. На практике это реализуется в ректификационных колонках.
Для растворов, значительно отклоняющихся от закона Рауля, на кривых зависимости давления пара над раствором от состава раствора часто имеется точка максимума или минимума. В экстремальных точках состав пара совпадает с составом жидкости (второй закон Коновалова). Такие смеси называются азеотропными, разделить их перегонкой (ректификацией) нельзя.
Для сильно различающихся по своей природе и по этой причине практически не смешивающихся жидкостей давление пара каждого компонента над смесью равно давлению пара чистого компонента. Тогда полное давление пара равно сумме давлений насыщенного пара обоих компонентов в чистом состоянии (при этой же температуре):
Р = РА + РВ. (4.19).
Однако температура кипения такой смеси ниже температур кипения каждой из индивидуальных жидкостей. Это свойство используется для перегонки с водяным паром путем барботирования его через не смешивающуюся с водой жидкость с последующей конденсацией выходящих паров. Перегонка с водяным паром позволяет отгонять высококипящие жидкости при температуре ниже 100оС.