Теоретические основы процесса

Поскольку входные окна пор и полостей цеолитов по размерам соизмеримы с молекулами, цеолиты позволяют выделять определенные типы молекул из молекулярных смесей. С точки зрения катализа, такая система является очень селективной, если активные центры расположены внутри полостей и пор. Очевидно, что доступность внутренней поверхности для реагирующих молекул является первым критерием возможности… Читать ещё >
Теоретические основы процесса (реферат, курсовая, диплом, контрольная)
Перспективными продуктами переработки скипидар является nолитерпеновые смолы, как жидкие, гак и твердые Основная область применения политерпенов различные адгезивы, куда они в качестве компонента, придающего клейкость основному полимеру (каучуку полиэтилену). Широко их используют и производстве клесв-расплввон и клеев чувствительных к давлению (липких лентах), Жидкие политернены применяю/ в качестве замасли ватоля для стекловолокна, и составах для жирования изделий из натуральной кожи. Кроме гою, жидкие политерпены применяю г и составе пленкообразующей полимерной композиции при изготовлении электроизоляционных термореактивиых пленок и покрытий, а также в составе олифы.
Полимеризация терпеновых углеводородом протекает по катионному механизму. В качестве катализаторов используют; алюмосиликатные катализаторы (природные и активированные глины, цеолиты), катализаторы Фриделя-Крафтса (апротонные кислоты Льюиса), минеральные кислоты (протонные кислоты Бренстеда), катализаторы Циглера-Натта, катионообменные смолы и др.
На основании имеющихся в научно-технической литературе данных по склонности к полимеризации терпеновые углеводороды следует расположить в ряд: р-пинен > дипентен > а-пинен > Дкарен > камфен [3],.
Структура р-пинена является наиболее «благоприятной» для полимеризации. Поскольку он имеет реакционноспособную экзометиленовую связь, первоначальная атака на которую приводит к образованию «спрятанного» циклического карбониевого иона. Кроме того, третичный катион, образующийся под действием катионных агентов, не попадает в «стерическую ловушку», поскольку происходит раскрытие напряженного четырехчленного цикла с образованием стерически благоприятного растущего третичного катиона. Все факторы положительно влияют на процесс полимеризации р-пинена до высокомолекулярных продуктов, идущий по схеме Обобщая многочисленные литературные данные, кислотно-каталическке превращения а-пинена можно представить в виде следующей схемы (рисунок 2.3) [3].
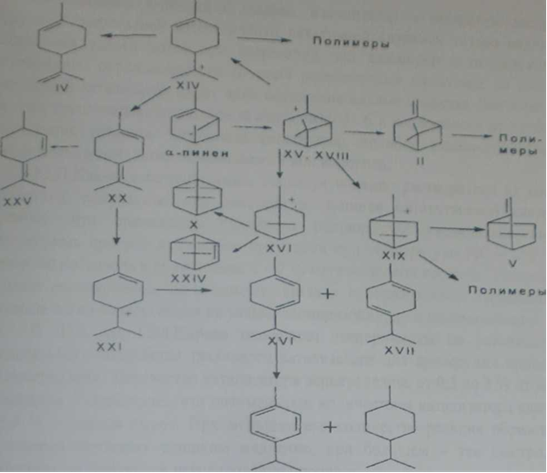
Рисунок 2.3 Схема кислотно — каталических превращений а-пинена IIр-пинен, IV-дипентен, V-камфен, VIIа-терпинен, VIII-терпинолен, Х-трициклен, XVI-y-терпинен, ХУ (ХУШ)-пинилкарбоний-ион, XVIборнилкарбоний-ион, Х1Х-изокамфилкарбоний-ион, XXV-изотерпинолен, XXII-p-цимол, XIV-терпинилкарбоний-ион, XXII-борнилен, ХХ1-карбоний-ион, ХХШ-Д3-р-ментен.
При полимеризации р-пинена в присутствии кислотных катализаторов получают политерпеновые смолы с высокой температурой размягчения (более 100 °С) и высоким выходом (90 — 98%). Полимеризация а-пинена также проходит с раскрытием напряженного четырехчленного кольца и образованием производного лимонена с относительно стабильной двойной связи внутри кольца, который далее полимеризуется по двойной связи внутри кольца, который далее полимеризуется по двойной связи с образованием твердых высокомолекулярных полимеров. При этом высказано предположение, что димеры образуются непосредственно из а-пинена, а образованию высокомолекулярных политерпенов предшествует изомеризация а-пинена в лимонен.
Политерпены могут быть получены при воздействии на терпеновые углеводороды титанового катализатора, применяющегося в промышленности для изомеризации а-пинена в камфен, Катализатор — титановую кислоту получают гидратацией каталитически неактивной двуокиси титана водными растворами едкого натра при нагревании под давлением с последующим разложением образовавшегося титаната разведенными кислотами на холоду. Титановый катализатор имеет ярко выражение кислые свойства. Значение pH водных суспензий катализатора лежит между 3- 6 в зависимости от глубины разложения титаната. Титановый катализатор, подобно алюмосиликатному, имеет подвижный, легко обмениваемый ион водорода.
Ю.П. Клюев с сотрудниками, исследуя влияние растворителя на состав продуктов, получаемых при действии на а-пинен метатитановой кислоты, отмечал, что применение полярного растворителя увеличивает выход полимерных продуктов. Реакцию проводили при температуре 100 — 150 °C в среде нитробензола в присутствии 1 — 2% метатитановой кислоты. Увеличение выхода политерпенов, по-видимому, связано с образованием карбкатионов, которые легко подвергаются не только изомеризации, но и полимеризации.
В JITA им. С. М. Кирова проводили эксперименты по установлению оптимального количества титанового катализатора для проведения процессов полимеризации. Количество катализатора варьировалось от 0,5 до 3% от массы скипидара. Установлено, что оптимальным количеством катализатора является 2−2,5% от массы сырья. При меньшем его количестве реакция образования полимеров протекает слишком медленно, при большем — так быстро, что затрудняется контроль и регулирование процесса.
Проведено много исследований по изучению возможности применения в качестве катализатора изомеризационных превращений терпеновых углеводородов не только синтетических, но и природных цеолитов. Так, для синтеза камфена использовали природные глины, бентонит, гидробиотит, каолин, вермикулит, монтомориллонит, диатомит.
Природные цеолиты — алюмосиликаты, содержащие в своем составе окислы щелочных и щелочноземельных металлов, отличающиеся строго регулярной структурой пор, которые в обычных температурных условиях заполнены молекулами воды. Эта вода, названная цеолитной, при нагреве выделяется, цеолиты «кипят», отсюда и произошло сочетание двух греческих слов «цео» и «лит», то есть «кипящие камни». Термин «Цеолиты» введен в минералогии свыше 200 лет назад шведским ученым Кронштедтом.
Если из цеолита удалить воду, поры могут быть снова заполнены водой или другим веществом. Цеолиты были названы молекулярными ситами, так как они способны разделять смеси различных веществ. Молекулярно-ситовые свойства цеолитов были впервые обнаружены в 1925 году Вейгелем и Штейнгофом у природного минерала шабазита. Тогда же начал создаваться промышленность синтетических цеолитов, но сдерживающим началом является высокая стоимость этих цеолитов.
Цеолиты образовались в результате изменения вулканических туфов в морских и континентальных бассейнах и представляют собой туфогенно-осадочный тип месторождения.
Поскольку входные окна пор и полостей цеолитов по размерам соизмеримы с молекулами, цеолиты позволяют выделять определенные типы молекул из молекулярных смесей. С точки зрения катализа, такая система является очень селективной, если активные центры расположены внутри полостей и пор. Очевидно, что доступность внутренней поверхности для реагирующих молекул является первым критерием возможности использования цеолита в качестве катализатора. Единственное исключение составляет клиноптилолит: в нем на долю внешней поверхности приходится 30% от обшей, вследствие чего он может активно катализировать превращения даже крупных молекул за счет их взаимодействия на внешней поверхности.
Оксидная форма клиноптилолита имеет вид: (К, Ка ^ СаЪО-АЬОз* lOSiOz’SHzO. Хорошо известно, что основной структурной единицей является тетраэдр Т04, где Т может быть кремнием или алюминием, который располагается в центре тетраэдра, а вершинах расположены четыре атома кислорода. Каждый атом кислорода является общим для двух тетраэдров. Таким образом, совокупность двух тетраэдров образует непрерывный каркас. Замена Si4' на Аг~ в тетраэдрах определяет отрицательный заряд каркаса, который компенсируется зарядами одновалентных или двухвалентных катионов, расположенных вместе с молекулами воды в каналах структуры. Катионы, находящиеся в каналах, легко замещаются, поэтому их называют обменным, в отличие от Si и А1, которые не обмениваются в обычных условиях и называются тетраэдрическими или каркасными.
Большинство авторов склоняется к мысли, что алюмосиликатные катализаторы являются протонными (бренстедовскими) кислотами, то есть наличие кислотных свойств связано у них с существованием структуры со слабо связанным протоном, способным отщепляться с присоединением к другим веществам, которые рассматриваются как сопряженное с данной кислотой основание.
Активирование молекулы углеводорода, проводящее ее в реакционноспособное состояние, происходит путем присоединения к этой молекуле слабо связанного с катализатором протона. В результате образуется ион карбония, который и является необходимой промежуточной стадией превращения углеводородов на алюмосиликатных катализаторах.