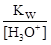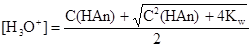Сильные кислоты (HCl, HBr, HI, HNO3, HClO4 и т. д.) в растворах полностью диссоциируют на ионы:
HAn + S > HS+ + An-,.
где HAn — молекула кислоты;
S — молекула растворителя.
В водных растворах диссоциация молекул сильной кислоты НАn представляется уравнением:
НАn + Н2О > Н3О+ + Аn-, (7).
что часто в упрощенном виде записывается как НАn > Н+ + Аn-.
Зная молярную концентрацию сильной кислоты в растворе и уравнение её диссоциации (7), легко рассчитать концентрацию ионов в растворе по уравнениям (1) и ионную силу раствора по формуле (3). Коэффициенты активности ионов можно определить по справочнику или рассчитать по формулам (4−6). Зная концентрации ионов и их коэффициенты активности, по формуле (2) определяются активные концентрации ионов.
Для кислоты НАn, диссоциирующей по уравнению (7), имеем:
a(H3O+) = C (H3O+)•f (H3O+) = C (HAn)•f (H3O+).
a(An-) = C (An-) f (An-) = C (HAn)•f (An-). (8).
Если в водном растворе сильной кислоты нет других источников ионов Н3О+ кроме кислоты НАn или ими можно пренебречь (ионизация воды, ионизация слабой кислоты, гидролиз соли), то рН такого раствора вычисляется по формуле:
рH = - lg a(H3O+) = - lg [C (HAn)•f (H3O+)]. (9).
При концентрации кислоты НАn меньше 10-6 моль/л нельзя пренебречь концентрацией ионов оксония Н3О+, образующихся вследствие ионизации воды по уравнению Н2О + Н2О Н3О+ + ОН-.
В этом случае из уравнения электронейтральности.
[H3O+] = [OH-] + [An-],.
после подстановки в него значений.
[An-] = C (HАn), и [OH-] = (IС = 10−6, f (X) = 1).
получаем квадратное уравнение вида.
[H3O+]2 — C (HAn)[H3O+] - Kw = 0.
Решая его относительно [H3O+], получаем.
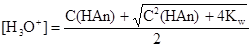
(10).
Так как в рассматриваемом случае активность ионов H3O+ равна их равновесной концентрации, то для вычисления рН раствора используем формулу рН = - lg[H3O+], (11).
подставляя в нее значение [H3O+], полученное из уравнения (10).