Влияние малых доз ионизирующего излучения на рост спонтанного уровня цитогенетических повреждений, обусловленных старением организма

Необходимо заметить, что используя явление перекрестного адаптивного ответа, когда адаптирующее и выявляющее воздействия являются факторами разной природы, можно попытаться перевести организм в новое адаптированное состояние не только ионизирующим излучением, но и другими воздействиями. Так, например, известно, что предварительная обработка клеток в культуре малыми концентрациями перекиси… Читать ещё >
Влияние малых доз ионизирующего излучения на рост спонтанного уровня цитогенетических повреждений, обусловленных старением организма (реферат, курсовая, диплом, контрольная)
Влияние малых доз ионизирующего излучения на рост спонтанного уровня цитогенетических повреждений, обусловленных старением организма
Заичкина С.И.
Известно, что облучение клеток в малых дозах ионизирующей радиации вызывает физиологический процесс, названный радиационным адаптивным ответом (РАО) [1]. Суть этого явления заключается в том, что предварительное облучение в малой дозе приводит к снижению чувствительности объекта к последующему повреждающему воздействию больших доз ионизирующего излучения. В 60-е годы уже было обнаружено повышение выживаемости предварительно облученных мышей [2]. К настоящему моменту РАО, в основном, исследован на различных культурах клеток по таким критериям, как клеточная гибель, хромосомные аберрации, мутации, неопластическая трансформация [3]. Явление цитогенетического РАО показано и на организменном уровне, хотя данные, полученные in vivo, зачастую противоречивы [4]. В подавляющем большинстве этих исследований РАО изучался в короткие сроки, но есть единичные работы, в которых РАО исследовали в более продолжительные сроки после адаптирующей дозы [4]. В наших предыдущих работах был впервые обнаружен эффект длительного, сравнимого со сроком жизни животного, сохранения цитогенетического РАО, индуцированного дозами 0,1 и 0,2 Гр [5, 6]. Как правило, механизмы, обусловливающие индукцию и проявление РАО, повышают также резистентность организма к другим мутагенным факторам, в частности, алкилирующим соединениям, тяжелым металлам, УФ [3]. Известно, что старение приводит к увеличению уровня цитогенетического повреждения. Поэтому представляет интерес исследование того, как механизмы, лежащие в основе РАО, влияют на накопление возрастных цитогенетических нарушений, причина которых окончательно не установлена.
В задачу настоящей работы входило изучение влияния однократного гамма-облучения в дозе 0,1 и 0,2 Гр на накопление спонтанных цитогенетических повреждений в течение жизни животного.
В экспериментах использовали самцов мышей линии SHK, 2-х месячного возраста. Животных содержали в виварии в стандартных условиях. Облучение осуществлялось от источника 60Со на установке ГУБЭ. Одна группа мышей была облучена в дозе 0,1 Гр при мощности дозы 0,125 Гр/мин. Другая группа мышей содержалась в аналогичных условиях в качестве контроля. Через 1 год в аналогичных условиях был проведен второй эксперимент, но облучение проводилось в дозе 0,2 Гр. Дозы 0,1 и 0,2 Гр были выбраны на основании наших предыдущих данных о том, что они индуцируют одинаковый уровень цитогенетического повреждения на единицу дозы [7]. Через 1 сутки, 2 недели, 1, 3, 6, 9, 12, 15, 18 и 20 мес мышей из контрольной и экспериментальной групп забивали методом цервикальной дислокации и готовили цитологические препараты костного мозга по стандартной методике.
Подсчитывалось количество полихроматофильных эритроцитов (ПХЭ) с микроядрами (МЯ). На каждую экспериментальную точку использовалось не менее 5 мышей, на каждую экспериментальную точку анализировали 25−30 тыс. ПХЭ. Всего в экспериментах было использовано 170 мышей. Проводилась статистическая обработка данных. При вычислении ошибок учитывались как разброс данных по отдельным мышам, так и ошибки, связанные с конечным числом клеток. При проверке статистической достоверности различий между группами использовали критерий Стьюдента.
В таблице приведены результаты определения количества ПХЭ с МЯ в костном мозге контрольных и облученных мышей в разные сроки после облучения. Для увеличения точности, данные двух экспериментов обработаны совместно. На рисунке для наглядности приведен также график полученной зависимости. Последняя точка таблицы и графика учитывает данные за 15, 18 и 20 месяцев.
Видно, что у мышей, переведенных однократным обучением в адаптированное состояние, уровень цитогенетических нарушений после первоначального всплеска, вызванного облучением в малых дозах, в дальнейшем уменьшался и к концу жизни животных становился заметно меньше, чем уровень спонтанных нарушений у необлученных животных (Р<0.001 для 12 месяцев, Р<0.0001 для последней точки).
Таблица 1 — Выход ПХЭ с МЯ в клетках костного мозга г-облученных и необлученных мышей в зависимости от возраста.
Вариант. | Время после облучения. | Кол-во мышей. | Кол-во ПХЭ. | Кол-во ПХЭ с МЯ. | Процент ПХЭ с МЯ1. |
Необлуч. | 1 сутки. | 0,430,06. | |||
облуч. | 1,640,12. | ||||
необлуч. | 2 недели. | 0,370,05. | |||
облуч. | 0,880,06. | ||||
необлуч. | 1 месяц. | 0,460,06. | |||
облуч. | 0,590,05. | ||||
необлуч. | 3 месяца. | 0,530,05. | |||
облуч. | 0,750,06. | ||||
необлуч. | 6 месяцев. | 0,810,05. | |||
облуч. | 0,890,09. | ||||
необлуч. | 9 месяцев. | 0,950,06. | |||
облуч. | 0,740,05. | ||||
необлуч. | 12 месяцев. | 1,010,07. | |||
облуч. | 0,670,05. | ||||
необлуч. | 17,7 месяцев2. | 1,010,06. | |||
облуч. | 0,620,05. |
- — показаны средние значения ошибка, учитывающая разброс данных по отдельным мышам и ошибки, связанные с конечным числом клеток.
- — данные объединены для 15, 18 и 20 месяцев
Таким образом, из представленных данных следует, что организм, переведенный в адаптированное состояние облучением в определенном режиме, длительно имеет повышенную устойчивость не только к радиации, что показано в нашей предыдущей работе [5], но и к факторам, обусловливающим старение животного. Обнаруженный эффект можно назвать стабилизацией генома, понимая под этим длительно сохраняющееся состояние, отличающееся повышенной устойчивостью к различного вида мутагенным факторам и старению.
Далее, если принять во внимание гипотезу накопления соматических мутаций, объясняющую старение, то можно ожидать, что эффект стабилизации генома проявится и в увеличении показателя, наиболее полно отражающего состояние организма — средней продолжительности жизни. Действительно, уже давно известны экспериментальные данные о том, что облучение в малых дозах увеличивают среднюю продолжительность жизни животных [8]. Использованные в этих работах дозы лежат в том же диапазоне, в котором нами был обнаружен длительно сохраняющийся РАО [5, 6].
Можно также высказать предположение, что повышенная стабильность генома организма приведет к уменьшению вероятности возникновения раковых заболеваний. Косвенным подтверждением этого являются данные по снижению спонтанной неопластической трансформации клеток С3Н10Т½ в результате облучения в малых дозах [9], а также результаты исследований, где показано, что повышенная концентрация радона в помещениях уменьшает риск заболевания раком легких [10].
Необходимо заметить, что используя явление перекрестного адаптивного ответа, когда адаптирующее и выявляющее воздействия являются факторами разной природы, можно попытаться перевести организм в новое адаптированное состояние не только ионизирующим излучением, но и другими воздействиями. Так, например, известно, что предварительная обработка клеток в культуре малыми концентрациями перекиси водорода также повышает устойчивость к последующему действию больших доз радиации. Особенно интересно, что адаптирующая обработка перекисью водорода не вызывала превышения уровня цитогенетического повреждения в клетках над уровнем фонового значением повреждений [11].
Пока неясно, насколько адаптированные состояния, вызванные малыми дозами ионизирующей радиации и химических веществ, одинаковы в отношении механизмов индукции, длительности сохранения и величины эффекта. Эксперименты по выяснению этих вопросов в настоящее время нами ведутся.
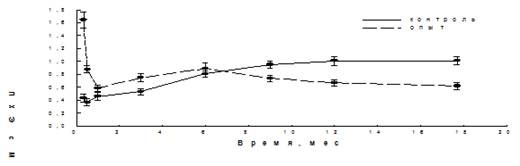
Рис. 1 — Зависимость выхода ПХЭ с МЯ в клетках костного мозга г-облученных и необлученных мышей от возраста
облучение животное цитогенетический повреждение Стоит подчеркнуть, что обнаруженный в данной работе эффект стабилизации генома отличается от широко известного явления антимутагенеза [12] тем, что химические антимутагены действуют только во время их наличия в организме и для заметного эффекта, сказывающегося на продолжительности жизни, необходимо их постоянное введение в организм. Развиваемые здесь идеи более созвучны таким концепциям, как адаптационная медицина, активационная медицина, неспецифическая сопротивляемость организма [13, 14]. Однако принципиально новым в наших работах является длительное сохранение адаптированного состояния, достигаемого однократным воздействием, в отличие от вышеперечисленных примеров, где требуется постоянное поддержание этого особого состояния организма.
Для обсуждения представленных результатов о стабилизации генома малыми дозами ионизирующего излучения нам кажется уместным привлечь гипотезу, высказанную в работе [15], о смене стратегий развития, применяемых живыми существами в процессе эволюции. При определенных условиях популяция может перейти к стратегии «К», отличающейся повышенной резистентностью к мутагенным факторам, низким темпом размножения, уменьшением частоты раковых заболеваний и увеличенным сроком жизни. В этой работе предполагается, что основным фактором, переключающим организм на новую стратегию, являются активные формы кислорода. В то же время известно, что при воздействии радиации важным, если не основным, повреждающим фактором являются те же активные формы кислорода. Таким образом, в рамках этой гипотезы, можно предполагать, что однократное радиационное воздействие способно переводить организм в устойчивое состояние.
Представленные данные позволяют сделать вывод, что малые дозы ионизирующей радиации подавляют рост уровня цитогенетических нарушений, обусловленный старением, до уровня ниже спонтанного, т. е. переводят организм в новое устойчивое состояние, отличающееся повышенной стабильностью генома.
- 1. Olivieri G., J. Bodycote, S. Wolff. Science. 1984. V. 223. P. 594−597.
- 2. Даренская П. Г., Кознова Л. Б., Акоев И. Г., Невская Г. Ф. Относительная биологическая активность излучений. Фактор времени облучения. М.: Атомиздат, 1968. 376 с.
- 3. Stecca C., Gerber G.B. Biochem. Pharmacol. 1998. V. 55. P. 941−951.
- 4. Котеров А. Н., Никольский А. В. Радиац. биология. Радиоэкология. 1999. T. 39(6). C. 648−662.
- 5. Балакин В. Е., Заичкина С. И., Клоков Д. Ю., Розанова О. М., Аптикаева Г. Ф., Ахмадиева А. Х., Смирнова Е. Н. ДАН. 1998. T. 363(6). C. 843−845.
- 6. Klokov D.Yu., Zaichkina S.I., Rozanova O.M., Aptikaeva G.F., Akhmadieva A.Kh., Smirnova E.N., Balakin V.Y. Abstract book of the 11th International Congress for Radiation Research. (Eds. M. Moriarty et al.). Dublin, Ireland, 1999. P. 255.
- 7. Заичкина С. И., Клоков Д. Ю., Розанова О. М., Аптикаева Г. Ф., Ахмадиева А. Х. Генетика. 1998. T. 34(7). P. 1013−1016.
- 8. Кузин А. М. Идеи радиационного гормезиса в атомном веке. М.: Наука, 1995. 158 с.
- 9. Azzam E.I., Toledo S.M., Raaphorst G.P., Mitchel R.E.J. Radiat. Res. 1996. V. 146. P. 369−373.
- 10. Dominguez I., Panneerselvam N., Escalza P., Natarajan A.T., Cortes F. Mutat.Res. 1993. V. 301. P. 135−141.
- 11. Дурнев А. Д., Середенин С. Б. Мутагены. Скрининг и фармакологическая профилактика воздействий. М.: Медицина, 1998. 328 с.
- 12. Гаркави Л. Х., Квакина Е. Б., Уколова М. А. Адаптационные реакции и резистентность организма. Ростов: Издательство Ростовского университета, 1990. 224 с.