Содержание продуктов свободнорадикального окисления в крови больных раком легкого

ДК и МДА являются продуктами ПОЛ, и наиболее часто используются в качестве маркеров свободно-радикального окисления липидов, и во многих случаях как основные показатели интенсивности окислительного стресса. Интенсификация процессов ПОЛ способствует образованию и накоплению токсических продуктов, клинически сопровождаясь развитием неспецифического синдрома эндогенной интоксикации. На базе… Читать ещё >
Содержание продуктов свободнорадикального окисления в крови больных раком легкого (реферат, курсовая, диплом, контрольная)
Содержание продуктов свободнорадикального окисления в крови больных раком легкого
Белоногов Р.Н., Лапешин П. В., Иванова Ю. Р., Покровский А. А., Шевцова А.О.
Рак легкого, которым ежегодно заболевает около 1 млн. человек, одна из причин смерти онкологических больных в большинстве стран мира. Известно, что в патогенезе злокачественной трансформации важную роль играет свободнорадикальное воздействие на клетки. Активные формы кислорода способны воздействовать практически на все биомолекулы. В большинстве исследований перекисное окисление липидов (ПОЛ) рассматривается в качестве универсального первичного механизма, обусловливающего возникновение и развитие различных патологических состояний, в том числе через повреждение других биомолекул и инициацию свободнорадикальных процессов. Однако ряд авторов указывают на существование альтернативного механизма формирования патологических состояний, связанных с инициацией активных форм кислорода и окислением клеточных протеинов как первичных субстратов реакций. В связи с этим целью данной работы явилось определение степени окислительной модификации белков и липидов у больных раком легкого. Для того, что бы оценить роль различных маркеров ОМБ и ПОЛ нами были проведены исследования по определению содержания КПБ, смп, битирозина, триптофана, SH-групп белков, ДК и МДА в плазме крови при различных гистологических формах заболевания — плоскоклеточном (ПКРЛ), мелкоклеточном (МКРЛ) раке легкого и аденокарциноме легкого (АКЛ).
На базе торакального отделения Красноярского краевого онкологического диспансера обследовано 18 больных с раком легкого в возрасте 30−55 лет. Кровь забиралась на следующий день после поступления больного в стационар, после чего центрифугированием отделяли плазму, в которой затем производились определения исследуемых показателей.
Метод определения КПБ основан на реакции взаимодействия окисленных аминокислотных остатков белков с 2,4-динитрофенил гидразином (2,4-ДФГ) с образованием производных 2,4-динитрофенилгидразонов. Оптическую плотность образовавшихся производных динитрофенилгидразонов регистрировали спектрофотометрически при длине волны 370 нм [5].
Метод определения среднемолекулярных пептидов. О содержании среднемолекулярных пептидов можно судить на основании прямой спектрометрии депротеинизированного супернатанта, полученного после осаждения белков раствором ТХУ при длине волны 254 нм [2].
Метод определения флуоресценции битирозина. В ходе одноэлектронного окисления тирозина образуется долгоживущий тирозил-радикал, который при взаимодействии с таким же радикалом образует битирозиновые сшивки. Битирозиновую флуоресценцию измеряют при длине волны 416 нм [4].
Метод определения сульфгидрильных групп в белках основан на взаимодействии SH-групп с ДТНБК (5,5'-дитио-бис-2-нитробензойной кислотой). В процессе этой реакции, происходит освобождение тионитрофенильного аниона (ТНФА). Количество образовавшегося ТНФА прямо пропорционально количеству свободных SH-групп белков, прореагировавших с ДНБК [3].
Определение ДК производили по измерению интенсивности поглощения в ультрафиолетовой области спектра при длине волны 232 нм в гептановом экстракте липидов тканей [1].

Рис. 1. Содержание КПБ в плазме крови при л = 370нм при различных гистологических формах рака легкого
Метод определения МДА основан на взаимодействии с 2-тиобарбитуровой кислотой, в результате которого образуется хроматоген, с максимумом поглощения при длине волны 532 нм [2.
Полученные результаты свидетельствуют о том, что действительно процессы свободно-радикального окисления играют важную роль в патогенезе данного заболевания.
Содержание КПБ является наиболее часто используемым показателем оценки степени окислительной модификации белков в большинстве научных работ. Содержание КПБ в плазме крови при длине волны 370 нм у здоровых людей составило 0,093±0,013 у.е./мг белка, в общей группе больных — 0,283 ±0,020 у.е./мг белка, что выше нормы на 202%. При ПКРЛ оно составляет 0,261±0,0574 у.е./мг белка, при МКРЛ — 0,288±0,0383 у.е./мг белка, при АКЛ — 0,3±0,044 у.е./мг белка, что соответствует повышению содержания КПБ на 177%, 207% и 220% соответственно (рис.1).
Для оценки степени фрагментации белков в крови использовалось определение уровня СМП в плазме крови и в эритроцитах. В клинике данный метод позволяет оценить интоксикацию в цельной крови, установить степень интоксикации, а также выбрать метод детоксикационной терапии.
В плазме содержание СМП составило в общей группе больных раком легкого 0,402 ± 0,016 у.е./мг белка, тогда как в плазме здоровых людей оно составляет в среднем 0,348 ± 0,007 у.е./мг белка, что на 16% ниже, чем в пораженной опухолью ткани. При разделении общей группы больных по гистологическому строению ткани легкого были получены следующие результаты. Содержание СМП при ПКРЛ составило 0,382 ± 0,028 у.е./мг белка, при АКЛ — 0,422 ± 0,036 у.е./мг белка и при МКРЛ — 0,403 ± 0,018 у.е./мг белка, что выше на 10%, 21% и 16% при ПКРЛ, АКЛ и МКРЛ соответственно, по сравнению с контролем (рис.2).

Рис. 2. Содержание СМП в плазме крови при различных гистологических формах рака легкого
Как видно из полученных данных, динамика изменения уровня карбонильных производных при длине волны 370 нм соответствует динамике изменения содержания СМП.
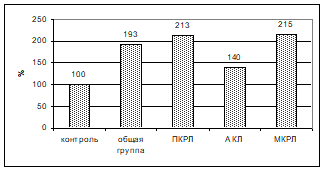
Рис. 3. Содержание битирозина в плазме при различных гистологических формах рака легкого
Битирозин, наряду с карбонильными производными белков, также является одним из наиболее часто используемых маркеров окислительного повреждения белков. Тирозин относится к группе аминокислот в наибольшей степени подверженным свободнорадикальным атакам, и, следовательно, является достаточно чувствительным маркером окислительного стресса. Также стоит отметить, что продукты окисления тирозина обладают определенной физиологической активностью. Содержание битирозина в контрольной группе составило 0,045 ± 0,001 у.е./мг белка, в общей группе больных — 0,087±0,008 у.е./мг белка, т. е. выше нормы на 93%. В зависимости от гистологии, при ПКРЛ — 0,096±0,009 у.е./мг белка, при АКЛ — 0,063±0,005 у.е./мг белка, и при МКРЛ — 0,097±0,004 у.е./мг белка, что соответствует увеличению содержания на 113%, 40% и 115% (рис.3).
SH-группы в белках содержатся главным образом в таких аминокислотах как цистеин и метионин. В целом, цистеин и метионин являются аминокислотами наиболее чувствительными к окислению. Отличие окисленных тиольных групп от других форм окислительной модификации белков в том, что клетка имеет механизмы, способные обратить окисление. Обратимое окисление/восстановление может защищать белки от других, более сильных повреждающих форм окислительной модификации, например образования карбонильных производных.

Рис. 4. Содержание SH-групп белков в плазме при различных гистологических формах рака легкого
Содержание SH-групп в белках при окислении также снижается. В плазме в контрольной группе оно составило 60,2±1,655 мкмоль/г белка, в общей группе больных — 7,025±1,423 мкмоль/г белка, при ПКРЛ — 6,032±2,293 мкмоль/г белка, при АКЛ — 4,542±1,794 мкмоль/г белка, при МКРЛ — 9,198±1,731 мкмоль/г белка (рис.4).
ДК и МДА являются продуктами ПОЛ, и наиболее часто используются в качестве маркеров свободно-радикального окисления липидов, и во многих случаях как основные показатели интенсивности окислительного стресса. Интенсификация процессов ПОЛ способствует образованию и накоплению токсических продуктов, клинически сопровождаясь развитием неспецифического синдрома эндогенной интоксикации.
В плазме крови содержание ДК в контрольной группе составило 17,3±0,1 мкмоль/мг белка, в общей группе больных 80,3±19,0 мкмоль/мг белка. В зависимости от гистолгического типа 93,0±19,5 мкмоль/мг белка — при ПКРЛ, при АКЛ — 57,1±32,7 мкмоль/мг белка, при МКРЛ — 87,0±37,4 мкмоль/мг белка (рис.5).
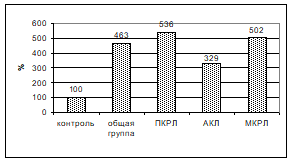
Рис. 5 Содержание ДК в плазме крови в зависимости от гистологического типа рака лёгкого
Содержание МДА в контрольной группе в плазме крови 4,31±0,37 мкмоль/мг белка, в общей группе — 14,42±4,58 мкмоль/мг белка, в зависимости от гистологической формы — 13,40±1,03 мкмоль/мг белка при ПКРЛ, 18,36±1,11 мкмоль/мг белка при АКЛ и 12,59±5,03 мкмоль/мг белка при МКРЛ (рис.6).
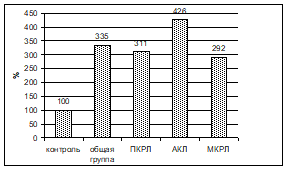
Рис. 6. Содержание МДА в плазме крови в зависимости от гистологического типа рака лёгкого
Полученные результаты свидетельствуют об увеличении интенсивности окислительных процессов в крови больных по сравнению со здоровыми людьми.
Таким образом, полученные нами результаты свидетельствуют о сложном характере нарушений в антиоксидантной системе больных раком легкого, которые в свою очередь зависят и от характера гистологической формы заболевания.
свободнорадикальный рак легкое кровь.
- 1. Гаврилов В. Б. Спектрофотометрическое определения содержания гидроперекисей липидов в плазме крови/В.Б. Гаврилов, М. И. Мишкорудная //Лабораторное дело — 1983. № 3. С.33−36.
- 2. Габриэлян Н. И. Средние молекулы и уровень эндогенной интоксикации у реанимационных больных./ Н. И. Габриэлян, А. А. Дмитриев, О. А. Савостьянова и др.// Анестезиол. и реаниматол. — 1985. — № 1: — С.36−38
- 3. Карузина А. И. Современные методы в биохимии/Карузина А.И., Арчакова А. И. — М.: Медицина. — 1977. — С.46−69.
- 4. Половинкин Л. В. Инструкция по определению веществ средней молекулярной массы и продуктов перекисного окисления белков в токсикологическом эксперименте /Л.В. Половинкин, С. В. Ткачев, Т. И. Половинкина, С. Н. Ежелева, Л.И. Сорока// Министерство здравоохранения республики Беларусь — 2005 г.
- 5. Levine L.R. Carbonyl assay for determination of oxidatively modified proteins/ L.R. Levine, J.A. Williams, E.R.Stadtman, E. Shacter// Methods in enzymology. — 1994. — Vol.233, P.346 — 357.