Лекция №4. Задачи по электропроводности водных растворов

В измерительном мосте переменного тока уравновешиваются не сопротивления, а полные сопротивления (Z), а нам надо знать Rp. Для того, чтобы в таком мосте были уравновешены и активные сопротивления, необходимо, чтобы углы сдвига фаз () в смежных плечах были бы так же одинаковы. Т.к. R=Zcos, то из уравнения 1 получаем R1/cos 1R3/cos 3= Rp/cos p1R4/cos 4 и если 1=р и 3=4, то. Непременным условием… Читать ещё >
Лекция №4. Задачи по электропроводности водных растворов (реферат, курсовая, диплом, контрольная)
Задача 1. Сопротивление 0,01 М раствора NaCl, измеренное в сосуде с электродами, емкостное сопротивление которых (l/S=0,5 см-1) равно 423 Ом. Определить величину удельной и эквивалентной электропроводностей, а также эквивалентную электропроводность раствора при бесконечном разбавлении, если предельная подвижность иона Na+ oNa=50,1 Ом-1см2г-экв-1, а иона Cl- oCl=76,4 Ом-1см2г-экв-1.
Решение: 1. Удельная электропроводность (Ом-1см2) определяется выражением:
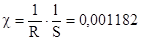
.
2. Эквивалентная электропроводность (Ом-1см2г-экв-1)определяется выражением:
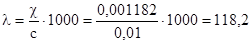
3. Эквивалентная электропроводность при бесконечном разбавлении (закон Кольрауша), Ом-1см2г-экв-1:
Задача 2. Эквивалентная электропроводность 0,014н раствора хлор-уксусной кислоты (СН2СlCOOH) при 25оС равна 109 Ом-1см2г_экв-1. Зная, что эквивалентная электропроводность при бесконечном разбавлении этой кислоты 0=389,5 Ом-1см2г-экв-1 определить:
- а) чему равна степень диссоциации ее в этом растворе;
- б) чему равна константа диссоциации ее.
Решение: 1. Определение.
Различие в значениях эквивалентной электропроводности при разных разбавлениях для слабых электролитов зависит практически только от степени диссоциации, т. е. /0=/0,, а т.к. 0=1, то =/0. Тогда.
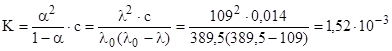
.
Измерение электропроводности растворов электролитов
Основано на определении величины сопротивления растворов электрическому току и производится обычно с помощью мостовых измерительных схем. Приведем рисунок эл. схемы измерительного моста. Принципиальная электрическая схема моста для измерения электропроводности:
Z1, Z2, Z3, Z4 — полные сопротивления плеч моста (импедансы).
ИН — индикатор нуля;
И.П. — источник питания.
В одну диагональ моста включен источник питания, а в другую — индикатор нуля.
В соответствии с законом Кирхгоффа при соотношении плеч моста Z1Z2=Z2Z4
Напряжение на его измерительной диагонали равно нулю и ток через индикатор нуля отсутствует, т. е. мост находится в равновесии. Если в качестве одного из плеч моста (например Z2) использовать сосуд с двумя электродами (датчик электропроводности), заполненный раствором электролита, то исходя из условия равновесия моста (уравнение 1) и зная сопротивление трех остальных его плеч, можно определить сопротивление раствора электролита и, следовательно, его электропроводность. В качестве источника питания можно использовать как постоянный, так и переменный ток.
Работа измерительного моста при питании постоянным током
Измерение электропроводности растворов Определяемое сопротивление датчика (Zд) является искомым сопротивлением раствора Rр.
ZдRр.
Однако, Rр не всегда является истинной величиной сопротивления раствора.
Измеряемое сопротивление датчика:
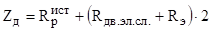
.
где — истинное сопротивление раствора; - сопротивление движению ионов в двойном электрическом слое, на границе раздела электрод-раствор; Rэ — сопротивление перемещению ионов из двойного слоя на поверхность электрода.
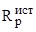
Обычно Rэ< и Rэ можно не учитывать, а Rдв.эл.сл. соизмеримо с .
Поэтому задача определения электропроводности раствора на постоянном токе состоит в уменьшении влияния Rдв на измеряемую величину Zд, т. е. в уменьшении поляризации электродов. Этого можно добиться путем увеличения плотности тока через раствор: будет быстро происходить взаимодействие ионов из раствора с поверхностью электрода.
Другой недостаток измерения на постоянном токе — изменение концентрации раствора при прохождении электрического тока за счет перемещения ионов к катоду и аноду.
Преимущество — простота.
На практике этот метод измерения э.п. используют если:
- а) влияние поляризации мало;
- б) изменением концентрации можно пренебречь.
Измерение электропроводности раствора мостом переменного тока Этот метод применяется в практике наиболее часто. Преимущество этого метода по сравнению с методом измерения при постоянном токе заключается в том, что возникшая во время каждого полупериода поляризация электродов нейтрализуется следующим полупериодом. При этом также компенсируются и возможные изменения концентрации раствора.
При использовании переменного тока определяется полное сопротивление датчика (Zд), состоящий из активной и реактивной составляющих.
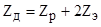
.
где Zр — импеданс раствора (активная и реактивная составляющая); Zэ — импеданс электрода (активная и реактивная составляющая).
Для того, чтобы знать как построить плечи моста переменного тока, надо знать как выглядит полное сопротивление датчика, измеряющего электрическую проводимость раствора. Т. е. следует Zд представить в виде эквивалентной электрической схемы. Такую схему можно показать следующим рисунком:
То есть эквивалентную электрическую схему полного сопротивления измерительной ячейки можно представить в виде трех последовательных полных сопротивлений (электрода, раствора, электрода), каждый из которых состоит из параллельных (одновременно действующих) активных сопротивлений и емкостных сопротивлений:
Rэ; Хэ — активное сопротивление и емкостное сопротивление движению ионов в двойном электрическом слое у поверхности электрода; Rр — искомое активное сопротивление раствора; Хр — емкостное сопротивление двойного слоя.
Таким образом искомое сопротивление раствора, определяющее его электропроводность Rр, составляет лишь часть общего сопротивления датчика. Поэтому измерение электропроводности раствора может быть достаточно точным, если Zр>>Zэ, тогда Zд=Zр. Т.к. полное сопротивление параллельного соединения R и С может быть выражено уравнением:

(3).
где R, X — активная и емкостная составляющая полного сопротивления.
Для полного сопротивления электродов справедливо равенство ZэXэ, т.к. Rэ>>Xэ и 1/Rэ+1/Xэ1/Хэ тогда подставляя значение Zэ=Xэ в уравнение (2), получим.
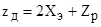
. (4).
Из последнего уравнения следует, что для повышения надежности определения электропроводности раствора электролита необходимо уменьшить величину Хэ.
Величина емкостного сопротивления выражается равенством:
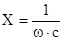
.
где — частота переменного тока; с — емкость.
Тогда Хэ можно уменьшить путем увеличения или С. На практике часто повышают и и С одновременно. Так для получения надежных данных по электропроводности растворов обычно рекомендуется применять переменный ток с частотой от 1000 до 20 000 Гц, а в качестве электродов использовать электроды с хорошо развитой поверхностью, что приводит к увеличению числа ионов в двойном электрическом слое, а следовательно и к увеличению емкости двойного слоя (обычно применяют черненую платину).
Добиваясь, таким путем, уменьшения Zэ получают, что ZдZр. Т. е. эквивалентную электрическую схему датчика упрощают до вида:
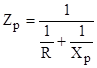
Тогда .
В измерительном мосте переменного тока уравновешиваются не сопротивления, а полные сопротивления (Z), а нам надо знать Rp. Для того, чтобы в таком мосте были уравновешены и активные сопротивления, необходимо, чтобы углы сдвига фаз () в смежных плечах были бы так же одинаковы. Т.к. R=Zcos, то из уравнения 1 получаем R1/cos 1R3/cos 3= Rp/cos p1R4/cos 4 и если 1=р и 3=4, то.
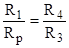
(5).
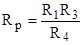
.
Откуда, зная R1, R3, R4 можно найти искомую величину Rр, а по ней и электропроводность раствора G=1/Rp.
Измерительный мост переменного тока при этом выглядит так:
Таким образом, мостом переменного тока измеряют G — электропроводность (или просто электрическую проводимость) раствора электролита.
G — (Ом-1) или (сименс).
Применение метода измерения электропроводности на практике
На практике измерение электропроводности растворов электролитов чаще всего используют в двух случаях:
- а) для контроля технологических процессов в которых происходит изменение концентрации растворов электролитов, например, процесса обессоливания воды на ХВО ТЭС;
- б) для целей химического анализа в сочетании с методами объемного анализа (нейтрализации, комплексообразования). Такой метод получил название кондуктометрического анализа.
Рассмотрим несколько подробнее.
а) Применение электропроводности для контроля технологических процессов на ХВО.
Непременным условием контроля за электропроводностью растворов электролитов в технологических процессах на ТЭС является знание величин удельных электропроводностей этих растворов. В то же время описанный метод дает возможность получать данные лишь о полной электропроводности растворов всегда разной при различных конструкциях датчиков.
Вычисление удельной электропроводности раствора электролита по измеренной полной ее величине G (Ом-1) проводят по уравнению:
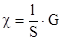
.
где l — расстояние между электродами, см; S — площадь электродов, см2.
В качестве электродов обычно используют две металлические пластины из платины или другого металла, весьма произвольной формы (чтобы увеличить емкость датчика). Во всех случаях отношение l/S остается постоянным и называется постоянной датчика, см-1:
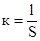
;
тогда; Ом-1см-1
Если электроды выполнены не в виде пластин, а в виде коаксиальных цилиндров, то постоянная такой ячейки, см-1:
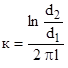
.
Электроды обычно закрепляются в корпусе датчика, выполненного из изоляционного материала, часто стекла. Иногда постоянную датчика трудно определить расчетным путем (сложная конфигурация, разные S, l и т. д.). Тогда К определяют экспериментально, путем измерения электропроводности стандартных растворов, т. е. растворов, имеющих точно известное значение удельной электропроводности при заданных t оС и концентрации С. В качестве стандартного раствора используют обычно раствор KCl.
Таблица. Значения удельной электропроводности раствора KCl, Ом-1см-1
Температура, оС. | Концентрация раствора KCl, г-экв/дм3 | |||
1,0 н. | 0,1 н. | 0,01 н. | ||
0,065. | 0,007. | 0,0008. | ||
0,092. | 0,010. | 0,0011. | ||
0,112. | 0,013. | 0,0014. | ||
Измеряя датчиком G раствора KCl при определенной температуре и концентрации рассчитывают к=/G=const.