Новый способ измерения объема левого предсердия

Исследования проводились на ультразвуковом аппарате фирмы «Toshiba» (Япония), датчик применялся с частотой 3 МГц. В М-режиме парастернальным подходом по длинной оси измеряли конечно-систолический (КСР) и конечно-диастолический (КДР) размеры ЛЖ. В В-режиме определяли площадь ЛЖ и его длину во время систолы и диастолы и по формуле «площадь-длина» вычисляли конечно-систолический (КСО… Читать ещё >
Новый способ измерения объема левого предсердия (реферат, курсовая, диплом, контрольная)
Хирургическая коррекция левой атриомегалии, несмотря на достижения современной кардиохирургии, имеет много нерешенных проблем. Пороки митрального клапана, изолированные или в сочетаниях являются преобладающими среди «клапанной патологии» и составляют до 80−90% всех случаев. Без оперативного вмешательства в течение первых 5 лет с момента появления симптомов заболевания и признаков сердечной недостаточности умирают 33−54% больных с митральным пороком (1).
Сужение левого атриовентрикулярного отверстия затрудняет прохождение крови из левого предсердия в левый желудочек, вызывая тоногенную перегрузку левого предсердия. При митральной недостаточности, обратный ток крови во время систолы левого желудочка через митральный клапан в полость левого предсердия приводит к объемной перегрузке ЛП. Эти патологические явления приводят к увеличению полости ЛП. В ряде случаев размеры левого предсердия и объем его достигают крайних степеней, и тогда используются термины «аневризматическое увеличение левого предсердия», «гигантское предсердие», «атриомегалия» (4,6).
По данным разных авторов, развитие атриомегалии у пациентов с митральным пороком сердца, встречается от 0,3% (7) до 10% случаев — (3,4,5,8). J. Plaschkes J. et al. (10) установил, что осложнение митрального порока развитием «гигантского левого предсердия» отмечается в 12% случаев.
Увеличенное в размерах левое предсердие может сдавливать расположенные вблизи органы. Наиболее значимым воздействием на окружающие органы увеличенным левым предсердием, является сдавление задне-базальных сегментов левого желудочка. При этом, явления сердечной недостаточности обуславливается не только клапанной патологией, но и снижением систолической функции левого желудочка. Компрессия средней и нижней доли правого легкого, левого главного бронха, приводят к развитию значительных вентиляционных нарушений. Левая атриомегалия, является значимым фактором риска хирургического лечения больных с митральным пороком сердца, сопряжена с возникновением в ближайшем послеоперационном периоде сердечной и легочной недостаточности. Так же высока госпитальная летальность, достигающая 20−35% (9). Piccoli G.P. et al. (8) провел сравнительный анализ результатов хирургического лечения пациентов, которым было выполнено протезирование митрального клапана и установил, что общая летальность составила 8,5%, а в группе больных с гигантским левым предсердием, летальность достигла 20%. Учитывая, что после коррекции митрального порока, при атриомегалии, не наблюдается значимого уменьшения размеров левого предсердия и как следствие, редукции его патологического воздействия на окружающие органы, возникла необходимость в хирургическом уменьшении его размеров.
Впервые в 1967 году, Johnson J. et al, сообщили об использовании пликации стенки левого предсердия для уменьшения его размеров. В дальнейшем были предложены различные модификации наложения плицирующих швов, применение резекции излишней стенки предсердия (9,11). Несмотря на появление в арсенале хирургов новых методик, направленных на коррекцию атриомегалии, а также возможности восстановления синусового ритма у части больных с митральным пороком, эта проблема не является решенной. Некоторые методики достаточно сложны, другие — недостаточно эффективно устраняют излишний объем левого предсердия. Некоторые хирурги не видят необходимости в коррекции атриомегалии и предпочитают не производить дополнительных манипуляций, считая, что это удлиняет время пережатия аорты и искусственного кровообращения. Вместе с тем, как показано целым рядом авторов (4,8,12), устранение только клапанной патологии у больных с атриомегалией не приводит к значимой редукции объема и размеров ЛП.
В тоже время многими авторами доказано, что коррекция атриомегалии положительно влияет как на ранний, так и на отдаленный послеоперационный период, а прогноз выживаемости у таких пациентов улучшается (4,12). В связи с этим, хирургическое лечение больных с митральным пороком, атриомегалией и мерцательной аритмией в последние годы получило новое развитие и предусматривает комплексный подход, направленный не только на устранение собственно клапанной патологии, но и на лечение осложнений, вызванных митральным пороком.
Для коррекции размера левого предсердия предложены различные хирургические техники, такие как пликация задней стенки (Kawazoe К., Beppu S., 1981;83), симметричная «Мерседес"-пластика (Дземешкевич С.Л. 2000), а также частичная резекция ЛП с использованием методик частичной (Sankar К, Farnsworth A., Garsia-Villarreal О., Winlaw D. и др., 1998;2001) или полной аутотрансплантации сердца (Batista R., 1994;95).
Целью исследования явилось достоверно измерить объем левого предсердия.
Для решения этой цели выставлены следующие задачи:
- 1. Разработать новый способ измерения объема ЛП и определить показания к атриопластике.
- 2. Произвести сравнительный анализ результатов определения объема ЛП данными эхокардиографии (ЭхоКГ) и предложенным новым способом.
Материал и методы исследования. В отделе кардиохирургии Национального научного центра имени А. Н. Сызганова с 2002 по 2007 года оперировано 176 пациентов с пороками митрального клапана, осложненными атриомегалией и мерцательной аритмией. Из них женщин — 103 (58,5%), мужчин — 73 (41,5). Средний возраст составил 41,5±27,5 лет. Распределение группы по недостаточности кровообращения было следующее: 119 (67,6%) пациентов с НК IIA, 57 (32,3%) — НК IIБ. По классификации NYHA: 124 (70,4%) пациента в ФК III, 52 (29,5%) — ФК IV. Все больные страдали мерцательной аритмией свыше 3 лет.
До и после операции всем пациентом выполняли электрокардиографию, рентгенологическое исследование, эхокардиографию, лабораторные исследования. Динамику полученных показателей оценивали после операции. Наиболее значимым исследованием для выявления атриомегалии является эхокардиграфия, позволяющая определить размер и объем левого предсердия. У 27 пациентов (41,5%) (I группа) определение объема полости левого предсердия производилось с помощью эхокардиографии, где до операции объем левого предсердия составил 270±60 мл и после операции — 140±25 мл.
Исследования проводились на ультразвуковом аппарате фирмы «Toshiba» (Япония), датчик применялся с частотой 3 МГц. В М-режиме парастернальным подходом по длинной оси измеряли конечно-систолический (КСР) и конечно-диастолический (КДР) размеры ЛЖ. В В-режиме определяли площадь ЛЖ и его длину во время систолы и диастолы и по формуле «площадь-длина» вычисляли конечно-систолический (КСО) и конечно-диастолический (КДО) объемы ЛЖ. В систолу и диастолу измеряли продольные размеры левого предсердия, соответствующие их длинным осям, и поперечные размеры соответствующие их коротким осям, а также площади камер (объем ЛП) по методу Simpson.
Интраоперационно у 38(58,5%) (II группа) пациентов измерялся объем левого предсердия по методу разработанному в клинике: до операции объем ЛП составил 520±45мл. и после операции — 175±20 мл. По данным эхокардиографии, размер полости левого предсердия уменьшился с 6,1−11,5 (в среднем 7,8 см) до 4,2−6,5 в среднем 4,9 см).
Размеры и объем левого предсердия измерялись при УЗИ исследовании (табл. 1.).
Таблица 1.
Показатели ЭХОКГ.
Параметры. | КДР, см. | КСР, см. | КДО, мл. | КСО, мл. | ЛП, см. | ФИ, %. | Объем ЛП, мл. | |
До операции. | 6.7 ±0.1. | 4.9 ±0.5. | 258±30. | 127±1.5. | 7.8 ±0.3. | 50,8±1. | 270±60мл. | |
После операции. | 5,9±0.5. | 4,1±0.3. | 173±48,5. | 72±10.5. | 4,8±1.0. | 58±1. | 140±25мл. | |
Разработанный способ осуществляют следующим образом: перед и после хирургической коррекции пороков митрального клапана производят измерение объема левого предсердия (рис. 1). Для этого вводят в левое предсердие (1) резиновую емкость, изготовленную из резиновой хирургической перчатки (2) через разрез в межпредсердной перегородке (3). Стерильная хирургическая перчатка (2), присоединена с двумя поливиниловыми трубками (4) и зафиксированы лигатурой. Через одну трубку вводится физиологический раствор при помощи 100-граммового шприца (5), а через другую из перчатки удаляют воздух. Когда из другой трубки польется жидкость, ее необходимо перекрыть и продолжить введение физиологического раствора до максимальных размеров. Максимальное количество введенной жидкости в резиновую емкость, расположенную в полости левого предсердия будет определять объем левого предсердия.
Протезирование митрального клапана с перевязкой ушка левого предсердия выполнена у 111 (63%) пациентов. В 62 случаях (35,2%) атриопластика по Kawazoe, у 3 (1,7%) пациентов — атриопластика типа «Мерседес» и в 5 случаях дополнена операцией «лабиринт».
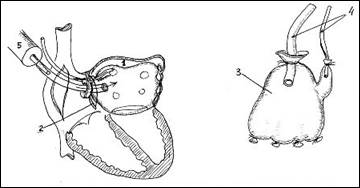
Рис. 1. Новый способ измерения объема левого предсердия
Результаты. В оценке непосредственных результатов оперативного лечения основное значение придавали восстановлению гемодинамики, отсутствию давления увеличенного левого предсердия на окружающие ткани. Кроме того, при оценке непосредственных результатов учитывали обратимость осложнений, развившихся до, во время и после операции. Применение левой атриопластики приводило к уменьшению размеров предсердия в среднем с 8,6 до 5,4 см. В ближайшем послеоперационном периоде инотропная поддержка допамина до 5 мг/кг/мин была лишь у 87(49,3%) больных, в остальных случаях кардиотоники не применялись. У 94 (53,4%) больных восстановился синусовый ритм, что позволяет улучшить качество жизни. объем левый предсердие эхокардиография атриопластика Методика операции левой атриопластики проста, практически мало удлиняет время проведения искусственного кровообращения или гипотермии. Так при проведении хронометрии: время, уделяемое на атриопластиику и герметизацию левого предсердия в условиях искусственного кровообращения, занимает — в среднем 10+4 мин. Левая атриопластика приводит к отчетливому уменьшению размеров левого предсердия, исчезновению синдрома сдавления задне-базального сегмента левого желудочка, уменьшению угла бифуркации трахеи, исчезновению сдавления главного левого бронха и нижних долей правого легкого. Этим можно объясняется уменьшение частоты и длительности острой сердечной недостаточности в ближайшем послеоперационном периоде. Благодаря ликвидации сдавления главного левого бронха и нижних долей правого легкого снижается длительность проведения послеоперационной искусственной вентиляции легких, улучшается расправление легких, что способствует снижению частоты возникновения послеоперационных ателектазов легких, пневмоний и трахеобронхитов. Это позволяет сократить сроки пребывания больных в реанимационном отделении, ускорить реабилитацию больных и в целом сократить сроки госпитализации.
Выводы
- 1. Разработанный способ более достоверно определяет объем полости левого предсердия и определяет показания к хирургическому лечению, когда левая атриомегалия не выражена и не доходит крайних степеней, дает возможность улучшить внутрисердечную гемодинамику, снизить частоту и длительность сердечной и дыхательной недостаточности в ближайшем послеоперационном периоде.
- 2. Сравнительный анализ результатов определения объема ЛП данными эхокардиографии и предложенным новым способом показал, что способ эффективный, достоверный, прост в применении и не требует дополнительных затрат.
- 1. Цукерман Г. И., Быкова В. А., Косач Г. А. // Отдаленные результаты протезирования митрального клапана. Кардиология, 1970, 3, стр. 16−22.
- 2. Дземешкевич С. Л., Стивенсон Л. У. // Болезни митрального клапана.-М., 2000.-С.287
- 3. Иваницкая М. А., Петросян Ю. С. // Рентгенодиагностика заболеваний сердца и сосудов.- М., 1970. С. 107−218.
- 4. Константинов Б. А., Черепенин Л. П., Таричко Л. П., Расулов И. Р., и др. // Грудная хир.- 1990.-№ 2.-С. 3−8.
- 5. Рабкин И.X., Григорян Э. А., Ажеганова Г. С. Рентгено-кардиометрия — Ташкент, 1975.
- 6. Бураковский В. И., Бокерия Л. А. // Сердечно-сосудистая хирургия — М. 1989.
- 7. Armstrong R.C., С1ine R.E., Stanford W. // Ann. thorac. Surg.- 1972. Vol. 14. P. 443−444.
- 8. Piccoli G.P., Massini C., Di Eusario G. et al. // J. cardiovasc. Surg.- 1984. Vol. 25. P. 328−336.
- 9. Kawazoe К; Beppu S., Takahara Y. et al. // J. Thorac. cardiovasc. Surg.- 1983.-Vol. 85. P. 885−892.
- 10. Plaschkes J., Borman I.В., Merin G. et al. // Ann. Surg.- 1971.-Vol. 174. P. 194−201.
- 11. Sinatra R., Pulitani I., Antonazzo A., Melina G. // Eur. J. Cardiothorac. Surg.-2001.-Vol. 20.-P. 412−414.
- 12. Beppu S., Kawazoe К., Nimura Y. et al. // Amer. J. Cardiol.- 1982. Vol. 49. P. 467−472. 13.