Сердечные гликозиды, нестероидные кардиотонические средства

Применение сердечных гликозидов в научной медицине началось в конце XVIII в. В 1785 г. издана монография английского врача Уильяма Уитеринга (1741−1799) «Сообщение о наперстянке и некоторых лечебных сторонах ее действия: заметки из практики при лечении отеков и некоторых других заболеваний». Сведения о лечебном действии листьев наперстянки Уитеринг почерпнул из списка трав, которые применяла… Читать ещё >
Сердечные гликозиды, нестероидные кардиотонические средства (реферат, курсовая, диплом, контрольная)
Сердечные гликозиды (от греч. glykys — «сладкий») — безазотистые соединения растительного происхождения, обладающие кардиотоническим действием. Благодаря этому эффекту их применяют для лечения ХСН.
ХСН — группа различных по механизму развития патологических состояний, при которых сердце постепенно утрачивает способность обеспечивать необходимый уровень кровоснабжения органов и тканей. Самая распространенная форма — сердечная недостаточность, обусловленная систолической дисфункцией левого желудочка. При этом уменьшается сердечный выброс, возрастают преднагрузка, ЧСС, ОЦК, возникают артериальная вазоконстрикция, гипертрофия и ремоделирование миокарда. Для ХСН характерен дисбаланс нейрогуморальных факторов: повышается секреция вазопрессина (АДГ), норадреналина, адреналина, эндотелинов, ренина, цитокинов, уменьшается секреция NO, простациклина и эндотелсиального гиперполяризующего фактора. Компенсированное состояние больных с начальными проявлениями ХСН поддерживают натрийуретические пептиды. По мере прогрессирования заболевания их концентрация в крови увеличивается (преимущественно мозгового натрийуретического пептида), что оценивают как неблагоприятный прогностический признак, указывающий на опасность острой сердечной недостаточности и фибрилляции предсердий.
Сердечные гликозиды в настоящее время получают из следующих лекарственных растений: наперстянки пурпуровой (Digitalis purpurea, Западная Европа), наперстянки крупноцветковой (Digitalis grandiflora, европейская часть России, Северный Кавказ, Урал), наперстянки шерстистой (Digitalis lanata, Балканский полуостров, Молдавия, Приднестровье), строфанта Комбе (Strophanthus kombe, древовидная лиана Восточной Африки).
Лечебные свойства растений, содержащих сердечные гликозиды, были известны в Древнем Египте. За 1600 лет до н.э. морской лук (Urgin-ea maritima, Средиземноморье) использовали как рвотное, слабительное, противовоспалительное и мочегонное средство.
Применение сердечных гликозидов в научной медицине началось в конце XVIII в. В 1785 г. издана монография английского врача Уильяма Уитеринга (1741−1799) «Сообщение о наперстянке и некоторых лечебных сторонах ее действия: заметки из практики при лечении отеков и некоторых других заболеваний». Сведения о лечебном действии листьев наперстянки Уитеринг почерпнул из списка трав, которые применяла знахарка из графства Шропшир. Уитеринг назначал порошок или настой листьев наперстянки пурпуровой 163 пациентам, страдавшим «водянкой». Он впервые описал правила сбора наперстянки и приготовления лекарственных форм, указал дозу порошка листьев наперстянки (0,12−0,36 г 2 раза в сутки) и схему применения («назначать до появления признаков интоксикации, а затем отменять на некоторое время»). В книге также перечислены симптомы дигиталисной интоксикации (рвота, возбуждение, нарушение цветового зрения, недержание мочи, брадикардия, судороги), поставлен вопрос о необходимости индивидуального подхода к лечению. Уитеринг установил, что наперстянка усиливает сердечные сокращения, а ее мочегонный эффект при «водянке» является вторичным. В 1875 г. Освальд Шмидеберг выделил гликозид наперстянки — дигитоксин. Длительное время препараты наперстянки применяли при отеках сердечного и внесердечного происхождения, даже для лечения туберкулеза и плеврита. В начале XX в. препараты наперстянки стали назначать больным с фибрилляцией предсердий. В России изучение наперстянки как сердечного средства начал в 1785 г. хирург С. А. Рейх.
Освоение географических ареалов растительного мира способствовало открытию новых гликозидсодержащих растений. В 1865 г. Дэвид Ливингстон и Дэвид Кирк описали брадикардическое действие африканского стрельного яда из семян строфанта гладкого. Врач экспедиции, Кирк, обратил внимание на изменение работы своего сердца каждый раз, когда чистил зубы зубной щеткой, лежавшей в сумке рядом с образцами яда из строфанта. В этом же году профессор Петербургской медико-хирургической академии Евгений Венцеславович Пеликан представил доказательства специфического действия на сердце строфанта, а год спустя — олеандра. В 1885—1890 гг. английский ученый Томас Фрезер выделил строфантин-К.
В конце XIX в. крупнейшим центром изучения сердечных гликозидов стала клиника Сергея Петровича Боткина, в которой экспериментальную лабораторию возглавлял Иван Петрович Павлов. Ученики Боткина и Павлова установили благоприятное влияние на кровообращение горицвета (Бубнов Н.А.), морозника (Чистович Н.Я.) и кендыря (Соколов Д.А.).
В 1896 г. основатель кафедры фармакологии Томского университета Павел Васильевич Буржинский установил, что гликозид периплоцин, выделенный химиком Э. А. Леманом из корня обвойника греческого, действует на сердце подобно гликозидам наперстянки, описал переходную и токсическую фазы интоксикации сердечными гликозидами.
В 1920;е гг. заведующий кафедрой фармакологии Томского университета и затем Томского медицинского института Николай Васильевич Вершинин предложил заменить западноевропейскую наперстянку пурпуровую отечественной наперстянкой крупноцветковой. Во время Великой Отечественной войны ученые Томского медицинского института — фармакологи Н. В. Вершинин, Евгения Михайловна Думенова и терапевт Дмитрий Дмитриевич Яблоков — ввели в медицинскую практику препараты желтушника, оказывающие, подобно строфантину-К, лечебное действие при острой сердечной недостаточности.
Молекулы сердечных гликозидов состоят из двух частей — сахаристой (гликон) и несахаристой (агликон), соединенных эфирной связью.
Гликоны влияют преимущественно на фармакокинетику сердечных гликозидов. Они представлены сахарами, широко распространенными в природе р-глюкозой, D-фруктозой, D-ксилозой, L-рамнозой), а также сахарами, входящими в состав только сердечных гликозидов р-дигитоксозой, D-цимарозой, D-олеандрозой). Сердечные гликозиды со специфическими сахарами медленнее метаболизируются в печени, поэтому действуют длительнее. У гликозидов наперстянки крупноцветковой, шерстистой и олеандра к сахарам присоединены остатки уксусной кислоты.
Сердечные гликозиды, содержащиеся в растениях, называют первичными (генуинными). В процессе сушки и хранения растений от сердечных гликозидов отщепляется одна молекула глюкозы, при этом образуются вторичные сердечные гликозиды (рис. 33−1-33−3).
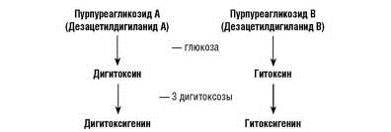
Рис. 33-1. Химический состав гликозидов наперстянки пурпуровой
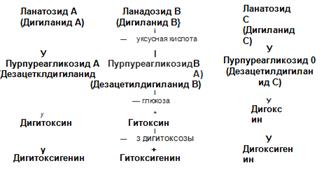
Рис. 33-2. Химический состав гликозидов наперстянки крупноцветковой и наперстянки шерстистой
Агликоны сердечных гликозидов определяют в основном биологическую активность, но также влияют на фармакокинетику. Так, от количества гидроксилов в агликонах зависит их полярность и, соответственно, растворимость в липидах и воде. Агликоны имеют стероидную структуру с цисконфигурацией колец. Метильные и альдегидные группы в стероидном кольце усиливают кардиотоническое действие.
Важное значение для фармакодинамики сердечных гликозидов имеет ненасыщенное лактоновое кольцо, присоединенное в положении С17 стероидного ядра. Сердечные гликозиды с пятичленным лактоновым кольцом получили название «карденолиды». Вещества, включающие шестичленное лактоновое кольцо, относят к классу буфадиенолидов. Карденолидами являются большинство сердечных гликозидов. Буфадиенолиды обнаружены в морском луке, морознике и секрете кожных желез лягушек и жаб (Ви1Ъ — род жаб). Амфибии в эволюции стали синтезировать сердечные гликозиды как средства защиты от хищников и для регуляции водно-солевого обмена через кожу. Буфадиенолиды в большом количестве синтезируются в организме амфибий, мигрирующих между ареалами с различным содержанием натрия хлорида в воде, из засушливых мест обитания в районы с высокой влажностью.
Эти вещества, блокируя №+, К±зависимую АТФазу сердца, почек и гладких мышц, усиливают сердечные сокращения, поддерживают гомеостаз ионов натрия и натрийурез, суживают сосуды. Они также активируют путь клеточной сигнализации, ответственный за развитие гипертрофии и фиброза миокарда. Уабаин является нейрогормоном, активирует центральную РАС, что сопровождается повышением функций симпатоадреналовой системы. Уабаин при участии РАС увеличивает выделение маринобуфагенина.
Разрабатываются методы купирования преэклампсии и гипертонического криза с помощью высокоочищенных антител к маринобуфагенину.
Фармакодинамика Действие на миокард Сердечные гликозиды оказывают положительное инои тонотропное действие и отрицательное хронои дромотропное действие.
Положительное инотропное (кардиотонигеское, систолическое) действие
При отсутствии сердечной недостаточности сердечные гликозиды одновременно с увеличением сократительной функции миокарда вызывают брадикардию и спазм периферических артерий, поэтому минутный объем крови снижается, а усиление сердечной деятельности направлено на преодоление повышенного сосудистого сопротивления и не сопровождается улучшением кровоснабжения органов.
При ХСН сердечные гликозиды нормализуют увеличенный симпатический тонус, препятствуют избыточному образованию ренина, ангиотензина II и катехоламинов, благодаря чему снижают ЧСС, способствуют расширению артерий с уменьшением их сопротивления. В итоге усиление сокращений декомпенсированного миокарда улучшает кровоснабжение органов.
Под влиянием сердечных гликозидов систола становится более энергичной и короткой, кривая ФранкаСтарлинга (зависимость силы сокращений сердца от давления или объема крови в полости желудочков) сдвигается вверх и влево. Таким образом, при лечении ХСН увеличение фракции выброса обусловлено не повышенным растяжением мышечных волокон (тоногенной дилатацией), а увеличением сократимости миокарда. Это имеет терапевтическое значение, так как при выраженной дилатации левого желудочка (конечный диастолический объем — более 260 мл) или повышении конечного диастолического давления в его полости свыше 18−20 мм рт.ст. механизм Франка-Старлинга перестает действовать. Дальнейшее переполнение желудочков кровью вызывает уменьшение сердечного выброса, митральную регургитацию, увеличивает потребность сердца в кислороде.
Сердечные гликозиды усиливают сокращения изолированных папиллярных мышц, верхушки миокарда, сердца эмбриона, когда еще не сформировались проводящая система и нервный аппарат.
Реполяризацию сарколеммы (восстановление потенциала покоя) осуществляет №+, К±зависимая АТФаза. Этот фермент удаляет из кардиомиоцитов три иона натрия, вошедших при деполяризации, в обмен на возврат в саркоплазму двух ионов калия. Транспорт ионов происходит активно, против электрохимического градиента с использованием энергии АТФ.
Во время реполяризации ионы кальция возвращаются в саркоплазматический ретикулум и удаляются во внеклеточную среду при участии Са2±зависимой АТФазы.
Дополнительным механизмом регуляции концентрации ионов кальция в кардиомиоцитах служит работа №+/Са2±обменника. Во время деполяризации он удаляет из кардиомиоцитов три вошедших иона натрия и пропускает в цитоплазму ион кальция. Во время реполяризации другой №+/Са2±обменник способствует поступлению в кардиомиоциты трех ионов натрия и выводит ион кальция. Транспорт ионов натрия происходит по электрохимическому градиенту.
В терапевтических дозах сердечные гликозиды обратимо и частично (примерно на 35%) блокируют фосфорилированную форму №±, К±зависимой АТФазы, связываясь лактоновым кольцом с сульфгидрильными группами а-субъединицы фермента на внешней поверхности сарколеммы. Ионы калия дефосфорилируют №±, К±зависимую АТФазу, что ослабляет блокирующий эффект сердечных гликозидов.
Блокада №±, К±зависимой АТФазы сердечными гликозидами сопровождается накоплением ионов натрия в кардиомиоцитах. Вследствие этого во время реполяризации нарушается функционирование Na±/Ca2± обменника, так как снижается электрохимический градиент для ионов натрия. Ионы кальция задерживаются в кардиомиоцитах, компенсаторно увеличивается их вход в саркоплазматический ретикулум. При последующей деполяризации этот дополнительный фонд Ca2+ поступает из саркоплазматического ретикулума в саркоплазму и повышает образование актомиозина. Ca2±зависимая АТФаза резистентна к действию сердечных гликозидов в терапевтических дозах.
Сердечные гликозиды устраняют дефицит ионов калия в кардиомиоцитах, вызванный избыточной при ХСН секрецией минералокортикоида альдостерона. Сердечные гликозиды ликвидируют гиперальдостеронизм:
- • уменьшают секрецию ренина — стимулятора РАС;
- • улучшают кровоснабжение печени, что способствует ускорению инактивации альдостерона;
- • подавляют синтез альдостерона в надпочечниках по принципу отрицательной обратной связи (имеют структурное сходство с гормоном).
Только при интоксикации сердечными гликозидами возникает дефицит ионов калия в миокарде (гипокалигистия), так как нарушается возврат этих ионов в кардиомиоциты из-за выраженной блокады №±, К± зависимой АТФазы.
У большинства больных ХСН сердечные гликозида не повышают кислородный запрос миокарда, так как уменьшают тахикардию и растяжение левого желудочка остаточным объемом крови, улучшают утилизацию глюкозы, лактата, пирувата, повышают сопряженность окисления и фосфорилирования, облегчают синтез макроэргов и гликогена. Только при внутривенном введении в больших дозах больным нестабильной стенокардией и инфарктом миокарда с распространенным атеросклерозом аорты и ее крупных ветвей сердечные гликозиды вызывают спазм периферических и коронарных сосудов, ухудшают кровоснабжение миокарда и повышают потребность сердца в кислороде. Положительное тонотропное действие Сердечные гликозиды препятствуют миогенной дилатации желудочков при ХСН. При их применении утрачивается значение тоногенной дилатации в обеспечении адекватного сердечного выброса, улучшаются биоэнергетика и синтез гликогена в миокарде.
Отрицательное хронотропное (диастолигеское) действие
Сердечные гликозиды в терапевтических дозах нормализуют ЧСС, устраняя тахикардию.
При ХСН тахикардия является вторым после тоногенной дилатации адаптационным механизмом, направленным на поддержание минутного объема крови. Однако укорочение диастолы при тахикардии ухудшает кровоснабжение сердца и истощает его энергетические ресурсы.
Тахикардия у больных ХСН развивается на фоне снижения парасимпатического и увеличения симпатического тонуса. Низкий сердечный выброс сопровождается ослаблением артериального барорефлекса (барорецепторы аорты и каротидного синуса поддерживают нормальный тонус блуждающего нерва и подавляют симпатическую активность). Симпатическую активацию вызывает раздражение барорецепторов правого предсердия и вен застойным объемом крови (рефлекс Бейнбриджа). В крови больных ХСН увеличены концентрация вазопрессина (АДГ), адреналина, норадреналина, активность ренина и ангиотензина II.
Сердечные гликозиды при ХСН восстанавливают нормальное соотношение парасимпатического и симпатического влияний на сердце: повышают парасимпатический тонус и снижают симпатический. Кардиотонический эффект сердечных гликозидов, создавая мощную пульсовую волну крови в период систолы левого желудочка, усиливает артериальный барорефлекс. Нервные импульсы от артериальных барорецепторов повышают тонус блуждающего нерва. Кроме того, сердечные гликозиды сенситизируют барорецепторный механизм в каротидном синусе, увеличивают выделение ацетилхолина из холинергических окончаний в сердце. Они также устраняют рефлекс Бейнбриджа, увеличивая венозный возврат.
Сердечные гликозиды в эквивалентных дозах обладают примерно одинаковым кардиотоническим действием, но отличаются по выраженности отрицательного хронотропного эффекта. В наибольшей степени ЧСС снижается под влиянием гликозидов наперстянки — дигитоксина, дигоксина и ланатозида Ц.
При тахикардии на фоне тампонады сердца и перикардита, когда отсутствует систолическая дисфункция, сердечные гликозиды не влияют на ЧСС.
Отрицательное дромотропное действие
Сердечные гликозиды замедляют проведение потенциалов действия в атриовентрикулярном узле, так как повышают влияние блуждающего нерва и прямо удлиняют рефрактерный период. Напротив, они укорачивают рефрактерный период кардиомиоцитов предсердий и волокон Пуркинье в желудочках.
При фибрилляции предсердий сердечные гликозиды вызывают «дробление» волн мерцания, что увеличивает поток потенциалов действия через атриовентрикулярный узел с последующим снижением проводимости.
Действие на гемодинамику Сердечные гликозиды оказывают благоприятное влияние на гемодинамику у больных ХСН.
- • Увеличивают минутный объем крови благодаря усилению сердечных сокращений и несмотря на ликвидацию тахикардии.
- • Нормализуют АД.
- • Вызывают разгрузку венозной части большого круга кровообращения, снижают венозное давление.
- • Уменьшают остаточный объем крови, диастолическое давление в левом желудочке и напряжение его стенки.
- • Снижают давление в сосудах малого круга кровообращения, что уменьшает риск отека легких, улучшает газообмен и увеличивает насыщение крови кислородом (становятся менее выраженными цианоз, одышка, гипоксия тканей, метаболический ацидоз).
- • Ускоряют кровоток.
Мочегонное действие Сердечные гликозиды уменьшают ОЦК и ликвидируют отеки у больных ХСН, увеличивая объемный кровоток в почках и ускоряя фильтрацию. Они также подавляют секрецию альдостерона и вазопрессина (АДГ), вследствие чего ослабляют реабсорбцию ионов натрия и воды, сохраняют в организме ионы калия.
Сердечные гликозиды не оказывают мочегонного действия при отеках, не связанных с ХСН.
Фармакокинетика Фармакокинетика сердечных гликозидов зависит от их физико-химических свойств. Неполярные сердечные гликозиды хорошо растворяются в липидах и легко преодолевают клеточные мембраны, полярные сердечные гликозиды растворяются в воде и имеют низкую способность к проникновению через мембраны.
Сердечные гликозиды накапливаются в скелетной мускулатуре, в миокард поступает не более 1% введенной дозы. У истощенных больных с плохо развитой мускулатурой и у детей концентрация сердечных гликозидов в крови относительно выше.
В крови сердечные гликозиды депонированы в связи с белками. При тиреотоксикозе связывание сердечных гликозидов возрастает, напротив, при гипотиреозе оно снижается. Соответственно концентрация свободной фракции в крови людей, страдающих патологией щитовидной железы, ниже или выше, чем у здоровых лиц. Дигоксин проникает через плаценту.
Элиминация сердечных гликозидов происходит путем биотрансформации и экскреции неизмененных веществ или их метаболитов с мочой или желчью.
По фармакокинетическим параметрам сердечные гликозиды можно разделить на 3 группы.
Неполярные липофильные сердечные гликозиды Дигитоксин содержит только одну гидроксильную группу в стероидном ядре.
При приеме внутрь в кровь всасывается 95−97% дозы дигитоксина. С белками плазмы прочно связано 95−97% молекул, поэтому проникновение в миокард происходит медленно. Низкое содержание белков в крови детей и больных гепатитом или нефрозом уменьшает связанную фракцию дигитоксина, что сказывается на эффективности препарата и скорости элиминации. Снижение доли связанной фракции всего на 1% увеличивает активную свободную фракцию почти вдвое.
Дигитоксин полностью реабсорбируется в почечных канальцах и подвергается энтерогепатической циркуляции, обладает выраженной способностью к материальной кумуляции. Коэффициент элиминации (часть дозы, элиминируемая за сутки) составляет всего 7%. Для удаления из организма дигитоксин окисляется в печени в более полярный дигоксин.
Дигитоксин назначают внутрь. Его кардиотонический эффект наступает через 1,5−2 ч, однократно введенная доза покидает организм только спустя 14−21 сут.
Сердечные гликозиды промежуточной полярности и липофильности Дигоксин содержит два гидроксила в стероидном ядре.
Биодоступность дигоксина составляет 70−80%, с белками плазмы связано 20−40% молекул, проникновение в миокард более быстрое, чем у дигитоксина.
У 10% людей в кишечнике присутствует бактерия ЕиЬайепит 1епШт, превращающая дигоксин в неактивное соединение. Это может стать причиной толерантности. Всасывание дигоксина в кишечнике ограничивается его интенсивным удалением из эпителия в просвет кишечника гликопротеином Р.
Дигоксин выводится с мочой в неизмененном виде, умеренно кумулирует, коэффициент его элиминации равен 20%.
Лекарственные средства дигоксин и ланатозид Ц принимают внутрь (начало действия — через 40−60 мин) или вводят внутривенно (начало действия — через 10−20 мин). Полная терапевтическая доза элиминируется в течение 5−7 сут.
Дигоксин является наиболее широко применяемым препаратом сердечных гликозидов благодаря проведению широкомасштабных контролируемых клинических исследований его эффективности, «удобной» фармакокинетике и доступной методике определения концентрации в крови. Ланатозид Ц обладает меньшей биодоступностью (40−60%) и слабым кардиотоническим эффектом.
Полярные водорастворимые сердечные гликозиды Строфантин-К содержит 2 гидроксила и альдегидную группировку в агликоне. При приеме внутрь строфантинК практически не всасывается (биодоступность — 3−8%). В крови он незначительно связывается с белками. Быстро проникает в миокард. Выводится в неизмененном виде с мочой и желчью, слабо кумулирует. Коэффициент элиминации строфантина-К — 40%.
Строфантин-К вводят внутривенно. Его кардиотоническое действие наступает через 3−10 мин. Полная терапевтическая доза элиминируется в течение 2−3 сут.
Параметры фармакокинетики, начало и продолжительность действия сердечных гликозидов приведены в табл. 33−1,33−2.
Пути введения При назначении сердечных гликозидов внутрь необходимо учитывать их раздражающее действие и инактивацию кишечной микрофлорой и пищей (рекомендуют прием через 1,5 ч после еды). У больных с застоем крови в системе воротной вены всасывание сердечных гликозидов в кишечнике существенно замедляется, однако по мере ликвидации застойных явлений биодоступность возрастает, что потребует коррекции дозы.
Таблица 33−1. Фармакокинетические параметры препаратов сердечных гликозидов
Препарат. | Биодоступность,. %. | Энтерогепатическая циркуляция, %. | Связь с белками плазмы,. %. | Коэффициент элиминации,. %. | Период полуэлиминации, ч. | Кумуляция. | |
Дигитоксин. | 95−97. | 7−16. | 95−97. | 168−192. | +++. | ||
Дигоксин. | 70−80. | 6−8. | 20−40. | 30−40. | ++. | ||
Ланатозид Ц | 40−60. | 5−7. | 20−25. | 28−36. | ++. | ||
Строфантин; К. | 5−8. | ; | 20−24. | ||||
Таблица 33−2. Начало, максимум и продолжительность действия препаратов сердечных гликозидов.
Препарат. | Пути введения. | Начало действия, мин. | Максимум действия, ч. | Продолжительность присутствия в организме однократно введенной дозы, сут. | |
Дигитоксин. | Внутрь. | 90−120. | 8−12. | 14−21. | |
Дигоксин. | Внутрь Внутривенно. | 45−60 10−20. | 1,5−2 0,75−2. | 5−6 5−6. | |
Ланатозид Ц | Внутрь Внутривенно. | 40−60 15−20. | 1,5−4,5 1−2. | 5−7 5−7. | |
Строфантин; К. | Внутривенно. | 3−10. | 0,5−1,5. | 2−3. | |
Сердечные гликозиды редко вводят внутривенно, только в неотложных случаях. При внутривенном вливании следует помнить о быстром создании в крови высоких концентраций сердечных гликозидов. Это увеличивает опасность передозировки и интоксикации. Для равномерного распределения в организме сердечные гликозиды вводят медленно, в течение 3−5 мин, в 10−20 мл 5% раствора глюкозы*.
Сердечные гликозиды не вводят внутримышечно из-за опасности некроза.
Применение сердечных гликозидов Показания к применению и критерии эффективности В настоящее время единственным сердечным гликозидом для лечения ХСН является дигоксин. Его назначают внутрь или реже внутривенно следующим категориям больных.
- • Больным ХСН в сочетании с постоянной тахисистолической формой фибрилляции предсердий.
- • Больным ХСН Ш-М функционального класса, вызванной систолической дисфункцией левого желудочка, если малоэффективна терапия ингибиторами АПФ, блокаторами рецепторов ангиотензина II, радреноблокаторами или мочегонными средствами.
Эффективность терапии дигоксином оценивают согласно следующим критериям.
- • Уменьшается выраженность клинических симптомов ХСН — одышки, цианоза, периферических отеков.
- • Снижается ЧСС до 60−70 в минуту (в покое).
- • Повышается толерантность к физической нагрузке (сердечный ритм учащается до 120 в минуту на фоне умеренной физической нагрузки).
- • На ЭКГ удлиняется до нормы интервал Р-Р, умеренно удлиняется интервал P-Q, сокращается комплекс ОРЭ, снижается сегмент ЭТ.
- • Улучшается внутрисердечная и системная гемодинамика.
- • Терапевтическая концентрация в плазме, определенная радиоиммунным методом, составляет 1−2 нг/мл (токсическая концентрация — 2,0−2,5 нг/мл).
Обычно начальная и поддерживающая дозы дигоксина составляют 0,125−0,25 мг/сут. Больным старше 70 лет, пациентам с заболеваниями почек или низкой массой тела назначают 0,125 мг в сутки или через сутки.
Противопоказания к применению Абсолютные противопоказания:
- • отравление сердечными гликозидами или подозрение на него;
- • атриовентрикулярная блокада М-Ш степени;
- • аллергические реакции (бывают редко). Относительные противопоказания:
- • выраженная синусовая брадикардия (пульс менее 50 в минуту);
- • фибрилляция предсердий с редким ритмом (мерцательная бради-аритмия);
- • синдром Вольффа-Паркинсона-Уайта (потенциалы действия из-за сниженной атриовентрикулярной проводимости распространяются по дополнительному пути, создавая опасность пароксизмальной тахикардии);
- • атриовентрикулярная блокада I степени;
- • желудочковые аритмии;
- • синдром гиперчувствительности барорецепторов аорты и каротидного синуса;
- • ХСН с фракцией выброса более 45%;
- • хроническая недостаточность правого желудочка;
- • диастолическая сердечная недостаточность;
- • ИБС (особенно нестабильная стенокардия и состояние после инфаркта миокарда);
- • обструктивная форма гипертрофической кардиомиопатии;
- • гипокалиемия;
- • гиперкальциемия;
- • почечная недостаточность;
- • тяжелые заболевания легких (дыхательная недостаточность М-Ш степени).
Гликозидная интоксикация Интоксикация сердечными гликозидами различной степени тяжести возникает у 5−15% больных, принимающих эти препараты. Сердечные гликозиды обладают малой широтой терапевтического действия. Симптомы интоксикации условно делят на кардиальные и внекардиальные.
Кардиальные симптомы. Нарушения со стороны сердца возникают в 51−90% случаях интоксикации сердечными гликозидами и характеризуются сменой двух стадий — переходной и токсической.
В переходной стадии возникает брадикардия, замедляется атриовентрикулярное проведение. Эти нарушения обусловлены рефлекторным повышением тонуса блуждающего нерва. Увеличивается пульсовое давление.
В токсической стадии возвращаются симптомы сердечной недостаточности, появляются коронарная недостаточность и аритмия:
- • желудочковая экстрасистолия по типу бии тригеминии;
- • желудочковая аритмия типа «пируэта»;
- • непароксизмальная тахикардия из атриовентрикулярного узла;
- • пароксизмальная предсердная тахикардия в сочетании с атриовентрикулярной блокадой;
- • остановка синусного узла с замещающим ритмом из атриовентрикулярного узла;
- • атриовентрикулярная блокада М-Ш степени.
В токсической дозе сердечные гликозиды, блокируя №+,-зависимую АТФазу на 60% и более, вызывают гипокалигистию — дефицит ионов калия в кардиомиоцитах. Гипокалигистия в сочетании с задержкой ионов натрия в клетках уменьшает поляризацию сарколеммы и отрицательный потенциал покоя. Это нарушает последующую деполяризацию и ослабляет сокращение миофибрилл.
Гипокалигистия отрицательно сказывается на синтезе макроэргов, гликогена, белка, способствует развитию внутриклеточного ацидоза и внеклеточного алкалоза.
В области миофибрилл значительно увеличивается содержание ионов кальция, поскольку нарушаются функционирование №+/Са2±обменника во время реполяризации и удаление ионов кальция из-за блокады Са2±зависимой АТФазы.
Мембранная Na+, К±зависимая АТФаза разных отделов сердца проявляет неодинаковую чувствительность к сердечным гликозидам. Они в 2,5 раза сильнее блокируют №+, К±зависимую АТФазу проводящей системы, чем соответствующий фермент сократительного миокарда. По этой причине в картине интоксикации ведущую роль играют нарушения сердечного ритма. Избыточное поступление в клетки проводящей системы ионов кальция, а также выделение под их влиянием норадреналина из симпатических окончаний сопровождается появлением эктопических очагов автоматизма, способных к спонтанной деполяризации.
Ионы кальция препятствуют развитию диастолы (возникает гиподиастолия), повреждают лизосомы и высвобождают ферменты, вызывающие некроз миокарда.
Ослабление систолы и неполноценная диастола ухудшают изгнание крови из полостей желудочков, что затрудняет субэндокардиальный кровоток и усугубляет ишемию миокарда.
Сердечные гликозиды в токсических дозах увеличивают тонус вен и артерий. Рост преди постнагрузки на сердце ускоряет развитие декомпенсации.
Внекардиальные симптомы. Внекардиальные симптомы интоксикации сердечными гликозидами: диспепсические (у 75−90% больных), неврологические (30−90%), смешанные (37%) и редко встречаемые (тромбоцитопения, аллергический васкулит, гинекомастия, бронхоспазм).
Диспепсические нарушения возможны в нескольких вариантах.
- • Анорексия в результате накопления норадреналина в пищевом центре гипоталамуса.
- • Тошнота и рвота, вызванные действием избытка дофамина на триггерную зону рвотного центра и ядро солитарного тракта.
- • Спастическая боль в животе и диарея на фоне повышенного тонуса блуждающего нерва.
- • Некроз кишечника из-за спазма сосудов брыжейки.
Неврологические проявления интоксикации обусловлены блокадой №+, К±зависимой АТФазы нейронов центральной и периферической нервной системы. При этом нарушаются выделение и кругооборот нейромедиаторов. У пострадавших появляются:
- • утомление, головная боль, мышечная слабость;
- • страх, бред, галлюцинации, судороги;
- • микрои макропсия, ксантопсия (предметы кажутся окрашенными в желтый или зеленый цвет), выпадение полей зрения.
Лечение гликозидной интоксикации. Прежде всего необходимо отменить препарат сердечного гликозида и другие лекарственные средства, повышающие концентрацию сердечных гликозидов в крови и чувствительность к ним (хинидин, амиодарон). Для успешной терапии определяют концентрацию электролитов в крови и проводят мониторирование ЭКГ. Назначают 50−100 г активированного угля (физический антагонист), в том числе при введении сердечных гликозидов внутривенно, так как они подвергаются энтерогепатической циркуляции.
Наибольшую сложность представляет купирование аритмий, вызванных сердечными гликозидами в токсических дозах. Антиаритмическая терапия включает следующие мероприятия:
- • ликвидацию гипокалигистии и уменьшение связывания сердечных гликозидов с Na+, К±зависимой АТФазой [при концентрации ионов калия в плазме ниже 4 мэкв/л вводят внутривенно препараты калия одновременно с его проводниками через мембраны, например, калия и магния аспарагинат (аспаркам, панангин или поляризующую смесь;
- • связывание ионов кальция в крови, чтобы уменьшить их поступление в кардиомиоциты (внутривенно натрия цитрат);
- • назначение антиаритмических средств, не снижающих атриовентрикулярную проводимость и сократительную функцию сердца (внутривенно лидокаин, фенитоин);
- • уменьшение аритмогенного действия норадреналина (при тахикардии вводят внутривенно радреноблокаторы);
- 1 Поляризующая смесь представляет собой раствор калия хлорида в 5% растворе глюкозы* с добавлением препаратов инсулина и аскорбиновой кислоты.
Левосимендан увеличивает ударный и минутный объем сердца, умеренно повышает ЧСС. Расширяет коронарные и периферические артерии, так как активирует АТФ-зависимые калиевые каналы гладких мышц и тормозит выделение эндотелина-1. Уменьшает АД, преднагрузку, постнагрузку и давление в малом круге кровообращения, повышает доставку кислорода к миокарду, усиливает почечный кровоток.
Для левосимендана характерна линейная фармакокинетика. Его биодоступность составляет 85%, связь с белками плазмы — 98%. Левосимендан конъюгирует в печени с глутатионом с образованием неактивного метаболита, который выводится с мочой и желчью. Период полуэлиминации левосимендана — 1 ч. Через 24 ч постоянной внутривенной инфузии 5% введенной дозы левосимендана трансформируется в активный метаболит OR-1896. Концентрация этого вещества нарастает в течение 4 сут. OR-1896 выводится в неизмененном виде с периодом полуэлиминации 75−80 ч. В итоге после внутривенного введения левосимендан оказывает действие в течение 6−24 ч.
При внутривенном введении левосимендан замедляет прогрессирование левожелудочковой сердечной недостаточности у больных инфарктом миокарда, улучшает гемодинамику при острой сердечной недостаточности с низким сердечным выбросом. Условием к применению левосимендана служит отсутствие тяжелой артериальной гипотензии (систолическое АД выше 85 мм рт.ст.).
Побочные эффекты левосимендана отмечаются у 2−6% пациентов. Особенно они выражены в первые 3 дня применения. Левосимендан может вызывать головную боль, головокружение, тошноту, артериальную гипотензию, тахикардию, трепетание и фибрилляцию предсердий, экстрасистолию, гипокалиемию.
Привыкание и синдром отдачи не характерны.
При ХСН применяют также антагонисты цитокинов в связи с доказанным участием цитокинов в патогенезе этого заболевания. Установлено, что в крови больных ХСН Ш-М функционального класса содержание фактора некроза опухоли-а возрастает в 12 раз по сравнению с его концентрацией у здоровых людей. В наибольшей степени содержание этого цитокина увеличивается у пациентов с тяжелыми клиническими проявлениями декомпенсации, выраженной кахексией и повышенной активностью РАС. При ХСН интенсивно образуются также другие провоспалительные цитокины — интерлейкины-1 и -6.
Провоспалительные цитокины синтезируются в кардиомиоцитах при увеличении конечнодиастолического давления в левом желудочке, а также в скелетных мышцах в ответ на гипоксию и перекисное окисление, вызванные снижением сердечного выброса. Третьим источником цитокинов служат иммунокомпетентные клетки, несущие рецепторы CD4. В них цитокины образуются под влиянием бактериальных эндотоксинов, поступающих в системный кровоток через поврежденную в результате венозного застоя стенку кишечника.
Цитокины оказывают отрицательное инотропное действие и нарушают эндотелийзависимое расширение артериол. Еще более опасны их долговременные необратимые эффекты: разрушение внеклеточного коллагенового матрикса миокарда, ремоделирование сердца (необратимая дилатация желудочков, гипертрофия), усиление апоптоза кардиомиоцитов и скелетной мускулатуры.
Имеются первые сообщения о клинических исследованиях при тяжелой ХСН у пациентов с кахексией ингибитора синтеза фактора некроза опухоли-а пентоксифиллина и ингибитора активности этого цитокина этанерцепта. Антиаритмические средства применяют для ликвидации или предупреждения нарушений ритма сердечных сокращений различной этиологии. Их подразделяют на лекарственные средства, устраняющие тахиаритмии, и средства, эффективные при брадиаритмиях. Нарушения сердечного ритма нередко служат жизненным показанием к неотложной терапии с помощью антиаритмических средств. В последние годы был установлен парадоксальный факт, что антиаритмические средства могут вызывать опасные аритмии. Это ограничивает их применение при аритмиях с минимальными клиническими проявлениями.
В 1749 г. было предложено принимать хинин при «упорных сердцебиениях». В 1912 г. к Карлу Фридриху Венкебаху (1864−1940), известному немецкому кардиологу, описавшему блокаду Венкебаха, обратился купец по поводу приступа сердцебиения. Венкебах поставил диагноз фибрилляции предсердий (мерцательной аритмии), но объяснил больному, что ее купирование лекарственными средствами не представляется возможным. Купец выразил сомнение в медицинской компетентности кардиологов и решил лечиться самостоятельно. Он принял 1 г порошка хинина, который в те времена имел репутацию средства от всех болезней. Через 25 мин ритм сокращений сердца нормализовался. С 1918 г. правовращающий изомер хинина — хинидин — по рекомендации Венкебаха введен в медицинскую практику.
В нормальных условиях функцию водителя сердечного ритма выполняют Р-клетки (от первой буквы англ. словосочетания Расе maker — «водитель ритма») синусного узла, обладающие автоматизмом — способностью спонтанно генерировать потенциалы действия. Мембранный потенциал Р-клетки постоянно меняется и проходит 4 фазы.
- • Фаза 4 — медленная спонтанная диастолическая деполяризация в результате ионных токов: входа ионов кальция, входа ионов натрия по f-каналам (от англ. funny — «странные»), Na+/Ca2±обмена.
- • Фаза 0 — положительный потенциал действия 20−30 мВ после достижения пороговой деполяризации в фазе 4.
- • Фаза 1 — ранняя быстрая реполяризация: кратковременный выходящий калиевый ток, вход анионов хлора.
- • Фаза 2 — плато реполяризации: сначала входящий деполяризующий кальциевый ток уравновешивается выходящим реполяризующим калиевым током задержанного выпрямления, затем кальциевые каналы быстро инактивируются и сохраняется только выход ионов калия.
- • Фаза 3 — завершающая реполяризация, обусловленная выходом ионов калия.
В реполяризации участвуют АТФазы. №+, К±зависимая АТФаза выводит во внеклеточную среду три иона натрия и возвращает в клетки два иона калия. Ca2±зависимая АТФаза удаляет ионы кальция во внеклеточную среду и вызывает их депонирование в саркоплазматическом ретикулуме и митохондриях.
Во время потенциала покоя быстрые натриевые и медленные кальциевые каналы закрыты (закрыты наружные активационные и внутренние инактивационные ворота), при деполяризации каналы открываются (открыты оба типа ворот), в период реполяризации ионные каналы находятся в инактивированном состоянии (наружные ворота открыты, внутренние — закрыты).
Потенциалы действия от Р-клеток распространяются по проводящей системе предсердий, атриовентрикулярному узлу и внутрижелудочковой системе волокон Гиса-Пуркинье (в направлении от эндокарда к эпикарду). В проводящей системе сердца клетки длинные и тонкие, имеют редкие латеральные связи. Потенциалы действия проводятся в 2−3 раза быстрее вдоль клеток, чем в поперечном направлении. Скорость проведения потенциалов действия в предсердиях составляет 1 м/с, в желудочках — 0,75−4,0 м/с.
В проводящей системе здорового сердца дистальнее синусного узла, спонтанная деполяризация протекает значительно медленнее, чем в синусном узле, и не сопровождается возникновением потенциалов действия. В сократительном миокарде спонтанная деполяризация не развивается. Клетки проводящей системы и сократительного миокарда возбуждаются потенциалами действия наиболее быстрого центра автоматизма — синусного узла.
В атриовентрикулярном узле потенциалы действия обусловлены медленным входом ионов кальция и быстрым входом ионов натрия, в системе Гиса-Пуркинье желудочков — быстрым входом ионов натрия. Скорость спонтанной деполяризации (фаза 4) зависит от тонуса вегетативной нервной системы. При усилении симпатических влияний повышается вход ионов кальция и натрия в клетки, что ускоряет спонтанную деполяризацию. Проводимость /-каналов повышается под влиянием цАМФ, образование которого стимулирует норадреналин. При увеличении парасимпатической активности интенсивнее выходят ионы калия. Это смещает в отрицательную сторону максимальный диастолический потенциал с замедлением спонтанной деполяризации.
Во время потенциала действия миокард находится в состоянии рефрактерности к раздражению. При абсолютной рефрактерности сердце неспособно к возбуждению и сокращению независимо от силы раздражения (фазы 0−2). Относительный рефрактерный период соответствует фазе 3 мембранного потенциала. В его начале сердце генерирует потенциалы действия в ответ на сильный стимул, в конце — потенциалы действия сопровождаются сокращением.
Для характеристики электрофизиологических свойств сердца и действия антиаритмических средств используют понятие эффективного рефрактерного периода (ЭРП). В течение ЭРП сердце возбуждается, но потенциалы действия не распространяются по проводящей системе.
Патогенез аритмий Тахиаритмии возникают вследствие нарушений генерации потенциалов действия или циркуляции круговой волны возбуждения.
Нарушение генерации потенциалов действия У больных аритмией в миокарде появляются эктопические водители ритма, обладающие большим, чем синусный узел, автоматизмом (рис. 34−1).
Потенциалы действия из эктопических очагов вызывают тахикардию и внеочередные сокращения сердца. «Развязыванию» аномального автоматизма способствует ряд факторов.
- * Возникновение или ускорение спонтанной деполяризации: облегчается вход ионов натрия и кальция под влиянием катехоламинов, гипокалиемии, растяжения сердечной мышцы, ишемии.
- • Уменьшение отрицательного диастолического потенциала покоя: клетки содержат избыток ионов натрия и кальция при гипоксии, блокаде Na+, К±зависимой АТФазы и Са2±зависимой АТФазы.
- • Укорочение ЭРП: повышается калиевая и кальциевая проводимость мембраны в фазе 2, ускоряется развитие следующего потенциала действия.
- • Слабость синусного узла с редкой генерацией потенциалов действия.
- • Освобождение проводящей системы из-под контроля синусного узла при блокаде проведения в зоне миокардита, гипертрофии миокарда, инфаркта, кардиосклероза.
Псевдоавтоматизм (триггерная активность) проявляется ранней или поздней следовой деполяризацией. Псевдоавтоматизм отличается от истинного тем, что деполяризация возникает не спонтанно, а вызывается предшествующим потенциалом действия. Ранняя следовая деполяризация, прерывающая фазу 3 трансмембранного потенциала, возникает при брадикардии, низком содержании ионов калия и магния во внеклеточной жидкости, активации аи p-адренорецепторов. Она обусловлена входом ионов кальция и натрия, создает опасность желудочковой тахикардии типа «пируэта» (torsades de pointes) с удлиненным интервалом Q-T. Поздняя следовая деполяризация развивается в фазе 4. Этот вид псевдоавтоматизма обусловлен перегрузкой миокарда ионами кальция при тахикардии, ишемии миокарда, стрессе, гликозидной интоксикации.
Круговая волна возбуждения.
Циркуляции волны возбуждения (от англ. reentry — «повторный вход») способствует гетерохронизм — несовпадение продолжительности рефрактерного периода разных участков миокарда. Круговая волна возбуждения, встречая рефрактерную деполяризованную ткань в основном пути проведения, направляется по дополнительному пути, но может вернуться в антидромном направлении по основному пути, если в нем закончился рефрактерный период. Пути для циркуляции возбуждения создаются в пограничной зоне между рубцовой тканью и неповрежденным миокардом. Основная круговая волна распадается на вторичные элементарные волны, которые возбуждают миокард независимо от потенциалов действия синусного узла. Срок циркуляции волны перед затуханием определяет количество внеочередных сокращений.
Виды, патогенетические механизмы и принципы терапии аритмий представлены в табл. 34−1.
Таблица 34−1. Аритмии и методы их терапии
Аритмии. | Патогенез. | Неотложная терапия*. | Поддерживающая терапия*. | |
Фибрилляция предсердий (мерцательная аритмия). | Циркуляция волны возбуждения по «функциональным» путям; стимуляция атриовентрикулярного узла^ нерегулярные частые сокращения желудочков. |
|
| |
Трепетание предсердий. | Циркуляция волны возбуждения по «анатомическим» путям в правом предсердии; нерегулярные частые сокращения желудочков. | Такая же, как при фибрилляции предсердий. | Такая же, как при фибрилляции предсердий (особенно показаны лекарственные средства, снижающие проводимость атриовентрикулярного узла). В отдельных случаях — абляция дополнительных путей проведения* ***. | |
Предсердная тахикардия. | Повышенный автоматизм, поздняя следовая деполяризация, циркуляция волны возбуждения в предсердиях. | Такая же, как при фибрилляции предсердий. | Такая же, как при фибрилляции предсердий или абляция очага тахикардии. | |
Тахикардия из атриовентрикулярного узла (пароксизмальная суправентрикулярная тахикардия). | Циркуляция волны возбуждения в атриовентрикулярном узле или окружающей его ткани. | Аденозина фосфат; снижение проводимости атриовентрикулярного узла; повышение тонуса блуждающего нерва: дигоксин, фенилэфрин. | Снижение проводимости атриовентрикулярного узла; пропафенон; абляция. | |
Аритмии. | Патогенез. | Неотложная терапия*. | Поддерживающая терапия*. | |
Синдром Вольффа-Паркинсона-Уайта:пароксизмальная Суправентрикулярная тахикардия. | Циркуляция волны возбуждения по «анатомическим» путям. | Такая же, как при тахикардии из атриовентрикулярного узла. | Блокада калиевых каналов; блокада быстрых натриевых каналов с восстановлением >1 с; абляция. | |
Синдром ВольффаПаркинсона-Уайта: фибрилляция предсердий с проведением потенциалов действия по дополнительным. | Очень частые сердечные сокращения из-за высокой проводимости дополнительных путей. | Электрическая кардиоверсия; прокаинамид. | Абляция; блокада калиевых каналов; | |
путям. | блокада быстрых натриевых каналов с восстановлением >1 с (не применяют лекарственные средства, значительно снижающие проводимость атриовентрикулярного узла). | |||
Желудочковая тахикардия в отдаленном периоде после инфаркта миокарда. | Циркуляция волны возбуждения по краю зоны инфаркта. | Лидокаин, амиодарон, прокаинамид; электрическая кардиоверсия. | Блокада калиевых каналов; блокада быстрых натриевых каналов; имплантация кардиовертера-дефибриллятора. | |
Желудочковая тахикардия у больных без морфологических нарушений в сердце. | Поздняя следовая деполяризация вследствие высокого симпатического тонуса. | Аденозина фосфат, верапамил, Р-адреноблокаторы; электрическая кардиоверсия. | Верапамил, Р-адреноблокаторы. | |
Фибрилляция желудочков. | Циркуляция волны возбуждения в желудочках. | Электрическая дефибрилляция; лидокаин, амиодарон, прокаинамид. | Имплантация кардиовертерадефибриллятора; блокада калиевых каналов; блокада быстрых натриевых каналов. | |
Аритмии. | Патогенез. | Неотложная терапия*. | Поддерживающая терапия*. | |
Врожденное удлинение интервалаР-Т — желудочковая тахикардия типа «пируэта». | Ранняя следовая деполяризация. | Электрокардиостимуляция; магния сульфат. | Р-Адреноблокаторы; электрокардиостимуляция. | |
- * Для неотложной терапии антиаритмические средства вводят внутривенно, для поддерживающей терапии — назначают внутрь.
- ** Проведение потенциалов действия в атриовентрикулярном узле подавляют р-адреноблокаторы, блокаторы кальциевых каналов, аденозина фосфат, дигоксин.
- *** Кардиоверсия — воздействие на миокард разряда конденсатора высокого напряжения, что вызывает деполяризацию всего миокарда и прерывает циркуляцию волны возбуждения.
- **** Абляция — деструкция очага тахикардии высокочастотными радиоволнами через катетер, введенный в сердце.
АНТИАРИТМИЧЕСКИЕ СРЕДСТВА Антиаритмические средства классифицируют согласно их влиянию на электрофизиологические свойства миокарда (табл. 34−2).
I класс — блокаторы натриевых каналов (мембраностабилизирующие средства) Антиаритмические средства этой группы блокируют открытые и инактивированные быстрые натриевые каналы, повышают или снижают проницаемость калиевых каналов. Препараты проникают к ионным каналам через поры (гидрофильный путь) или липидный бислой мембран (гидрофобный путь).
Средства I класса подавляют эктопические очаги и в меньшей степени влияют на функции синусного узла. Не влияют на закрытые натриевые каналы в период диастолического потенциала покоя, поэтому в большей степени тормозят деполяризацию в клетках с частыми потенциалами действия. Большая частота деполяризации возникает в зонах ишемии миокарда, на которые антиаритмические средства оказывают преимущественное действие.
Антиаритмические средства I класса (см. рис. 34−1):
- • замедляют спонтанную деполяризацию (фаза 4);
- • увеличивают отрицательный диастолический потенциал покоя;
- • повышают пороговый потенциал, при котором возникает быстрая деполяризация;
- • изменяют скорость нарастания потенциала действия (фаза 0);
Таблица 34−2. Антиаритмические средства.
Антиаритмическ ое средство. | Блокада ^±каналов. | ЭР П. | Блокада Са2 ; каналов. | Влияние на вегетативную нервную систему. | Особенности действия. | Частота Аритмогенного действия, %. | ||
состояние канала*. | время восстановлени я после блока, с. | |||||||
I класс — блокаторы натриевых каналов (мембраностабилизирующие средства). | ||||||||
1А — антиаритмические средства, удлиняющие ЭРП. | ||||||||
Хинидин. | О. | 1**. | Блокада, а — адренорецепторов, антихолинергическ ое действие на сердце. | Блокирует №+, К+ -зависимую АТФазу. | ||||
Прокаинамид. | О. | 1,8. | т. | Блокада симпатических ганглиев. | Образует активный метаболит — ^ацетилпрокаинамид. | |||
ІВ — антиаритмические средства, укорачивающие ЭРП****. | ||||||||
Лидокаин. | И>0. | 0,1. |
| ; | ; | Местный анестетик. | ||
Фенитоин. | и. | 0,2. | Снижение центрального симпатического тонуса. | Противоэпилептическ ое средство. | ||||
Антиаритмическое средство. | Блокада ^-каналов. | ЭРП. | Блокад. | Влияние на. | Особенности. | Частота. | ||
Состояние канала. | Время восстановления после блока, с. | аСа2 -каналов. | вегетативную нервную систему. | действия. | Аритмогенного действия,. %. | |||
ІС — антиаритмические средства, оказывающие разнонаправленное влияние на ЭРП. | ||||||||
Морацизин. | 0=И. | Антихолинергическ ое действие на сердце. | Расширяет коронарные и периферические сосуды. | |||||
Этацизин. | о=и. | ; | ; | |||||
Пропафенон. | о=и. | 41*****. | Блокада вадренорецепторов. | Образует активный метаболит — 5- гидроксипропафен он. | ||||
II класс — в-адреноблокаторы*******. | ||||||||
Пропранолол. | Блокада вадренорецепторов. | Оказывает антиангинальное и гипотензивное действие. | ||||||
III класс — блокаторы калиевых каналов, удлиняющие ЭРП. | ||||||||
Амиодарон. | и. | 1,6. | Т. | Блокада аи вадренорецепторов. | Оказывает антиангинальное и гипотензивное действие, образует активный деэтилированный метаболит. | |||
Антиаритмическо е средство. | Блокада ^-каналов. | ЭР П. | Блокада Са2 — каналов. | Влияние на вегетативную нервную систему. | Особенности действия. | Частота Аритмогенного действия,. %. | ||
состояние канала*. | Время восстановления после блока, с. | |||||||
Соталол. | И. | 1,4. | Т. | ; | Блокада вадренорецепторов. | |||
Нибентан*. | И. | Т. | ; | Антихолинергическо е действие на сердце. | ||||
IV класс — блокаторы кальциевых каналов********. | ||||||||
Верапамил. | Т. | Оказывает антиангинальное и гипотензивное действие. | ||||||
Другие антиа. | штмические средства. | |||||||
Аденозина фосфат. | Агонист АІрецепторов. | Оказывает наиболее Короткое действие. | ||||||
- • Преимущественное влияние на натриевые каналы, находящиеся в открытом (О) или инактивированном (И) состоянии. ** удлинение ЭРП. ***| - укорочение ЭРП.
- **** Оказывают терапевтическое действие при желудочковых аритмиях.
- ***** удлиняет рефрактерный период в предсердиях, атриовентрикулярном узле, системе Гиса-Пуркинье.
- ****** укорачивает ЭРП в проводящих путях и удлиняет в сократительном миокарде.
- ******* Сведения о р-адреноблокаторах приведены в лекции 12.
- ******** Оказывают терапевтическое действие при суправентрикулярных аритмиях.
- • изменяют продолжительность реполяризации и ЭРП;
- • препятствуют ранней и поздней следовой деполяризации;
- • прекращают циркуляцию круговой волны возбуждения.
Антиаритмические средства, тормозящие быструю деполяризацию в фазе 0, замедляют распространение потенциалов действия по проводящей системе сердца и ослабляют сердечные сокращения. Для влияния на проводимость также имеет значение срок восстановления натриевых каналов после блока. Средства, вызывающие кратковременный (менее 1 с) блок натриевых каналов, не снижают проводимости.
Необходимо учитывать антихолинергический, а-адреноблокирующий и ганглиоблокирующий эффекты антиаритмических средств.
Серьезную проблему представляет аритмогенное действие антиаритмических средств. Оно возникает у 2−15% больных. Например, при трепетании частота сокращений предсердий составляет 300 в минуту, что при атриовентрикулярном проведении 2:1 или 4:1 соответствует ЧСС 75−150 в минуту. Если антиаритмическое средство уменьшает частоту сокращений предсердий до 220 в минуту, атриовентрикулярное проведение доходит до соотношения 1:1, при этом ЧСС повышается до 220 в минуту. Особенно значительно увеличивает атриовентрикулярную проводимость хинидин, оказывающий антихолинергическое действие.
При блоке калиевых каналов удлиняются потенциал действия и ЭРП, что создает опасность ранней следовой деполяризации с развитием желудочковой тахикардии типа «пируэта». Замедление проведения по системе Гиса-Пуркинье желудочков облегчает циркуляцию волны возбуждения.
Грозным осложнением антиаритмической терапии является электромеханическая диссоциация. Она характеризуется клиническими симптомами остановки кровообращения при наличии на ЭКГ сохранной биоэлектрической деятельности миокарда. При этом появляются медленный синусовый или узловой ритм, фибрилляция предсердий с низкой ЧСС, переходящие в идиовентрикулярный ритм и асистолию. Патогенез электромеханической диссоциации обусловлен резким снижением сократимости миокарда, который перестает реагировать на потенциалы действия водителей ритма.
^ класс — блокаторы натриевых каналов, удлиняющие эффективный рефрактерный период Антиаритмические средства 1А класса при суправентрикулярных и желудочковых нарушениях сердечного ритма:
- • замедляют спонтанную деполяризацию в фазе 4 (блокируют открытые натриевые каналы);
- • подавляют нарастание потенциала действия в фазе 0;
- • удлиняют ЭРП (в предсердиях — на 50%, в желудочках — на 10%), блокируя калиевые каналы в фазах 2 и 3 реполяризации; * * прекращают циркуляцию волны возбуждения, удлиняя ЭРП в основном проводящем пути (круговая волна не возвращается в антидромном направлении).
Антиаритмические средства IA класса в различной степени снижают проводимость, сократимость миокарда и АД, особенно при парентеральном введении и сопутствующей сердечной недостаточности.
Несмотря на принципиальное сходство механизма действия, антиаритмические средства IA класса различаются по фармакодинамике, фармакокинетике и применению.
Хинидин — правовращающий стереоизомер хинина, алкалоид коры хинного дерева (род Cinchona).Применяется в виде сульфата.
Хинидин подавляет вход ионов натрия в фазе 0, ингибирует Na+, К±зависимую АТФазу, ослабляет сердечные сокращения. Проводимость натриевых каналов после блокады восстанавливается примерно через 3 с. Оказывает а-адреноблокирующий и антихолинергический эффекты, может вызывать артериальную гипотензию и тахикардию. Повышение ЧСС обусловлено уменьшением тормозящего влияния блуждающего нерва на синусный узел. Непостоянно влияет на атриовентрикулярную проводимость, так как вызываемое хинидином прямое удлинение ЭРП атриовентрикулярного узла частично нивелируется антихолинергическим эффектом.
Хинидин хорошо всасывается из кишечника. При приеме внутрь за 30 мин до еды максимальная концентрация в крови достигается спустя 1−3 ч, при приеме через 15 мин после еды — спустя 3−6 ч. Около 80% молекул хинидина связано с кислым a-i-гликопротеином. Содержание хинидина в желудочках в 20 раз, а в предсердиях — в 10 раз выше, чем в плазме. Хинидин подвергается интенсивной биотрансформации в печени (один из метаболитов обладает антиаритмическими свойствами), ингибирует изоферменты 2D6 и 3А4. Около 20−30% дозы выводится почками в неизмененном виде. Почечная недостаточность способствует кумуляции хинидина (особенно при щелочной реакции мочи). Период полуэлиминации и длительность действия составляют 5−7 ч. Применяют препарат хинидина пролонгированного действия хинипэк. Он состоит из нерастворимой пористой основы, содержащей хинидина бисульфат, который лучше хинидина сульфата растворяется в воде и равномернее выделяется из пористой массы.
Максимальная концентрация хинидина после приема внутрь таблеток длительного действия создается через 3−6 ч, антиаритмический эффект сохраняется 10−12 ч. Таблетки проглатывают, не разжевывая и не рассасывая.
Хинидин обладает широким спектром антиаритмической активности. Его назначают для купирования приступов и курсового лечения трепетания и фибрилляции предсердий, тахикардии из атриовентрикулярного узла (пароксизмальной суправентрикулярной тахикардии), желудочковой тахикардии и экстрасистолии.
Нежелательные эффекты хинидина — атриовентрикулярная блокада, уменьшение фракции выброса, артериальная гипотензия. Хинидин как холиноблокатор обладает аритмогенным действием. Это опасно возникновением желудочковой тахикардии типа «пируэта» и даже фибрилляции желудочков у пациентов с трепетанием и фибрилляцией предсердий. Известно рикошетное действие хинидина: подавление аритмии в первые 2 ч после приема и ее усугубление в последующие 2−4 ч.
Хинидин может нарушать зрение и слух, у 30−50% больных вызывает диспепсические расстройства (длительная диарея сопровождается гипокалиемией с опасностью аритмии). При постоянном применении хинидин оказывает гепатотоксическое действие, вызывает синдром системной красной волчанки (боль в мелких суставах, плеврит, пневмония, антинуклеарные антитела, редко — перикардит с тампонадой сердца) и аллергические реакции (крапивницу, лихорадку, фотодерматоз, тромбоцитопеническую пурпуру).
Прокаинамид — производное местного анестетика прокаина. По влиянию на электрофизиологические параметры сердца близок к хинидину, но меньше ослабляет сердечные сокращения и лишен аадреноблокирующего и антихолинергического эффектов. Снижает атриовентрикулярную проводимость.
Прокаинамид принимают внутрь, вводят внутримышечно и внутривенно. Из пищеварительного тракта всасывается 75−96% дозы в течение 15−30 мин, у больных инфарктом миокарда и сердечной недостаточностью всасывание замедляется. После внутримышечного введения максимальная концентрация в крови достигается спустя 5−30 мин. Связь с белками плазмы — всего 15%.
Около 50% дозы прокаинамида ацетилируется в печени, остальное количество выводится почками в неизмененном виде. Период полуэлиминации составляет 3−7 ч, продолжительность антиаритмического эффекта — 3−4 ч.ацетилпрокаинамид обладает выраженными антиаритмическими свойствами.
Прокаинамид применяют при пароксизмальном трепетании и фибрилляции предсердий, пароксизмальной желудочковой тахикардии, желудочковой экстрасистолии, для предупреждения расстройств сердечного ритма после операций на сердце, крупных сосудах и легких.
Прокаинамид блокирует симпатические ганглии, поэтому снижает артериальное и венозное давление, может вызывать ортостатический коллапс.
У 25−30% больных при длительной терапии прокаинамидом возникает синдром системной красной волчанки, у 0,2% развивается аплазия костного мозга. При высокой концентрации прокаинамида в крови создается опасность аритмогенного действия (желудочковой тахикардии типа «пируэта»).
Антиаритмические средства класса противопоказаны при выраженной синусовой брадикардии, кардиогенном шоке, внутрипредсердной, атриовентрикулярной (И-Ш степени) и внутрижелудочковой блокадах, тяжелой ХСН и артериальной гипотензии (особенно после инфаркта миокарда), заболеваниях печени и почек, повышенной чувствительности. С осторожностью их назначают при синдроме Вольффа-Паркинсона-Уайта.
Кроме того, хинидин не назначают при тромбоцитопении, беременности и гликозидной интоксикации (вытесняет дигоксин из связи с белками плазмы и вдвое повышает концентрацию его свободной фракции, ингибирует, подобно сердечным гликозидам, №+, К±зависимую АТФазу миокарда, повышает поступление сердечных гликозидов в головной мозг и усиливает их нейротоксическое действие).
№ класс — блокаторы натриевых каналов, укорачивающие эффективный рефрактерный период Мембраностабилизирующие средства В класса лидокаин и фенитоин препятствуют возникновению и прогрессированию желудочковых форм аритмии.
- • Замедляют спонтанную деполяризацию в фазе 4 (блокируют инактивированные и открытые натриевые каналы).
- • Не изменяют (лидокаин) или ускоряют (фенитоин) нарастание деполяризации в фазе 0.
- • Укорачивают ЭРП, повышая выход ионов калия в фазах 2 и 3.
- • Прекращают циркуляцию волны возбуждения, так как устраняют зону «функционального» блока в основном проводящем пути.
Антиаритмические средства В класса оказывают преимущественное влияние на желудочки. Известно, что в желудочках потенциалы действия имеют большую продолжительность, реполяризация протекает медленно, поэтому натриевые каналы длительно открыты и инактивированы.
Средства В класса не нарушают проведения потенциалов действия по сердцу и не снижают сократимости миокарда. Проводимость натриевых каналов после блока восстанавливается быстро. Лидокаин обладает свойствами местного анестетика, фенитоин является противоэпилептическим средством.
Лидокаин при приеме внутрь подвергается интенсивной пресистемной элиминации (биодоступность — 1535%). После внутривенного введения максимальная концентрация в крови достигается «на конце иглы», при внутримышечном введении — через 5−15 мин. В крови 5080% молекул связано с белками. Хорошо проникает через плаценту (в крови новорожденного концентрация достигает 40−55% уровня в крови матери).
При однократном введении элиминация лидокаина из крови происходит в 2 этапа.
• Сначала концентрация быстро снижается в результате перераспределения в скелетные мышцы и жировую ткань (период полуэлиминации — 8 мин). *.
Продукты окислительногодеалкилирования лидокаина — моно-этилглицилксилидид и глицилксилидид — оказывают слабое антиаритмическое действие, глицилксилидид конкурирует с лидокаином за связь с натриевыми каналами, что ослабляет терапевтический эффект. Оба метаболита могут вызывать рвоту и судороги. Метаболиты и неизмененный лидокаин (10% дозы) выводятся почками. При инфузии в течение суток и длительнее, а также при тяжелой сердечной недостаточности и заболеваниях печени клиренс лидокаина снижается втрое.
Лидокаин вливают внутривенно (сначала в виде болюса, затем капельно) для неотложной терапии желудочковой тахикардии и экстрасистолии, вводят внутримышечно для профилактики фибрилляции желудочков при инфаркте миокарда и гликозидной интоксикации.
Нежелательные эффекты лидокаина: артериальная гипотензия, головная боль, головокружение, сонливость, ухудшение течения сердечной недостаточности. При быстром внутривенном вливании лидокаина возможно развитие судорог.
В токсических дозах лидокаин вызывает тремор, расстройство артикуляции речи, нистагм, дезориентацию, парестезию, потерю сознания.
Лидокаин противопоказан при синдроме слабости синусного узла, брадикардии, атриовентрикулярной блокаде 11−111 степени, артериальной гипотензии, заболеваниях печени и почек, индивидуальной непереносимости. С осторожностью его назначают больным миастенией, эпилепсией, психическими расстройствами, а также амбулаторно лицам, профессиональная деятельность которых требует высокой психической и двигательной активности.
Фенитоин блокирует инактивированные натриевые каналы, ускоряет проведение потенциалов действия по сердцу, усиливает сократительную функцию миокарда. Уменьшает центральное симпатическое влияние на сердце.
Фенитоин принимают внутрь, при этом он подвергается пресистемной элиминации (биодоступность — 20−50%). Связь с альбуминами плазмы — 90−95%. Стабильный антиаритмический эффект наступает через 6−12 ч. Фенитоин окисляется изоферментами 2С9, 2С19, 3А4 и 3А5, 35−60% дозы выводится с мочой, 40−65% - с желчью. Период полуэлиминации вариабельный (4−60 ч) и зависит от дозы и степени индукции цитохрома Р- 450.
Фенитоин применяют при желудочковой аритмии, возникшей на фоне гликозидной интоксикации, общей анестезии, катетеризации сердца и коронарографии, а также при врожденном синдроме удлиненного интервала О-Т, если не эффективны р-адреноблокаторы.
При передозировке фенитоина возникают артериальная гипотензия, трепетание предсердий, атаксия, нистагм, гипертермия, лимфаденопатия, боль в суставах, затрудняется дыхание, нарушается психика. У пациентов, длительно принимавших фенитоин, возможны диспепсия и гиперплазия десен. Фенитоин как индуктор цитохрома Р-450 ускоряет инактивацию фолиевой кислоты, витаминов D и К с развитием соответственно макроцитарной анемии, остеомаляции и геморрагического синдрома.
Фенитоин противопоказан при заболеваниях печени, почек, сердечной недостаточности, миастении, беременности, истощенным больным.
Ю класс — блокаторы натриевых каналов, оказывающие разнонаправленное влияние на эффективный рефрактерный период Антиаритмические средства этой группы — морацизин, этацизин* и пропафенон — блокируют открытые и инактивированные натриевые каналы.
Отечественное антиаритмическое средство морацизин — структурный аналог антипсихотических средств, ыпроизводное фенотиазина, имеет также свойства антиаритмического средства 1 В класса. Не нарушает сократимости миокарда, хотя длительно блокирует открытые и инактивированные натриевые каналы, обладает умеренными коронарорасширяющими, спазмолитическими, гипотензивными и антихолинергическими свойствами. К недостаткам морацизина можно отнести выраженную пресистемную элиминацию и в связи с этим низкую (38−50%) биодоступность, а также короткое действие (период полуэлиминации — 0,7−4,1 ч). Один из метаболитов морацизина обладает антиаритмической активностью.
Морацизин вводят внутривенно и внутримышечно для купирования пароксизмальной желудочковой тахикардии и принимают внутрь для профилактики рецидивов этой формы аритмии. Он хорошо переносится, хотя изредка вызывает головокружение, головную боль, онемение языка, кожный зуд, боль в эпигастральной области, имеет слабые аритмогенные свойства. При внутримышечном введении возможна местная болезненность, недопустимо подкожное введение. Морацизин противопоказан при слабости синусного узла, атриовентрикулярной блокаде 11−111 степени, кардиогенном шоке, инфаркте миокарда. Интервал между приемами морацизина и антидепрессантов группы ингибиторов МАО должен составлять не менее 2 нед.
Этацизин близок по химическому строению и эффектам к морацизину. По механизму действия его можно отнести к 1С и IV классам, так как он блокирует натриевые и кальциевые каналы. Этацизин удлиняет время проведения потенциалов действия и рефрактерный период в предсердиях, атриовентрикулярном узле, системе Гиса-Пуркинье.
Этацизин* назначают внутрь и внутривенно при пароксизмальной фибрилляции предсердий, суправентрикулярной и желудочковой экстрасистолии, пароксизмальной и постоянной желудочковой тахикардии, в том числе при синдроме Вольффа-Паркинсона-Уайта. Период полуэлиминации и длительность терапевтического эффекта составляют 2,5 ч.
Пропафенон представляет собой смесь Dи L-стереоизомеров. Блокирует натриевые и калиевые каналы в предсердиях и желудочках с медленным восстановлением проводимости после блока. D-изомер является антагонистом р-адренорецепторов, что обеспечивает 40% антиаритмического действия. Укорачивает ЭРП в проводящих путях и удлиняет его в сократительном миокарде. Замедляет проведение потенциалов действия в основных и дополнительных путях предсердий, атриовентрикулярного узла и желудочков.
Пропафенон полностью всасывается из кишечника, подвергается пресистемному метаболизму (биодоступность — 50%). Окисляется изоферментом 2D6 с образованием 5-гидроксипропафенона. Этот метаболит аналогично пропафенону снижает проводимость натриевых каналов, но не блокирует радренорецепторы. Период полуэлиминации составляет 4−5 ч, длительность действия — 4−10 ч.
Пропафенон назначают внутрь при трепетании и фибрилляции предсердий пароксизмального типа, пароксизмальной суправентрикулярной тахикардии, обусловленной синдромом Вольффа-Паркинсона-Уайта. Пропафенон менее эффективен при желудочковых аритмиях у пациентов с нестабильной стенокардией, кардиосклерозом, после трансмурального инфаркта миокарда.
Побочные эффекты этацизина и пропафенона — блокады и аритмогенное действие (увеличивают частоту сокращений желудочков при трепетании и фибрилляции предсердий, вызывают желудочковую тахикардию типа «пируэта», что повышает летальность). Они также ухудшают течение ХСН, вызывают диспепсические расстройства, головокружение, головную боль, нарушают вкусовые ощущения и зрение. Этацизин* ухудшает коронарный кровоток. Пропафенон ингибирует изофермент 2D6, как р-адреноблокатор может вызывать брадикардию и бронхоспазм.
Антиаритмические средства 1С класса противопоказаны при слабости синусного узла, синоатриальной блокаде II степени, атриовентрикулярной блокаде 11−111 степени, блокаде внутрижелудочковой проводящей системы, кардиогенном шоке, тяжелой сердечной недостаточности, артериальной гипотензии, нарушении функций печени и почек. Осторожность необходима при атриовентрикулярной блокаде I степени, неполной блокаде ножек пучка Гиса и волокон Пуркинье.
I класс — р-адреноблокаторы р-Адреноблокаторы устраняют аритмогенное влияние катехоламинов при многих патологических состояниях. Средства этой группы, блокируя р-адренорецепторы, изменяют электрофизиологические процессы в синусном узле, предсердиях, атриовентрикулярном узле и желудочках.
• Прекращают циркуляцию волны возбуждения в атриовентрикулярном узле.
В качестве антиаритмических средств наибольшее значение имеют:
- • р-адреноблокаторы с мембраностабилизирующим действием (пропранолол);
- • кардиоселективные ргадреноблокаторы (бетаксолол, бисопролол, метопролол, эсмолол).
Антиаритмическое действие более выраженно у липофильных р-адреноблокаторов, тем более что они препятствуют развитию гипокалиемии.
В больших дозах р-адреноблокаторы прямо блокируют кальциевые и натриевые каналы мембран. Такое мембраностабилизирующее действие особенно выражено у пропранолола. р-Адреноблокаторы снижают ЧСС, замедляют проведение потенциалов действия по проводящей системе сердца, нормализуют кислородный запрос миокарда.
р-Адреноблокаторы применяют для купирования и курсового лечения синусовой тахикардии, трепетания предсердий, тахисистолической формы фибрилляции предсердий, тахикардии из атриовентрикулярного узла (пароксизмальной суправентрикулярной тахикардии), суправентрикулярной и желудочковой экстрасистолии. Высокая эффективность р-адреноблокаторов отмечается при аритмии у больных ИБС, пролабированием митрального клапана, гипертрофической кардиомиопатией, тиреотоксикозом, ревматизмом, а также на фоне врожденных и приобретенных синдромов удлинения интервала О-Т и при гликозидной интоксикации.
Для получения быстрого эффекта р-адреноблокаторы вводят внутривенно медленно в 10−20 мл 5% раствора глюкозы. Антиаритмическое действие развивается либо мгновенно (тахикардия из атриовентрикулярного узла), либо через 20−60 мин. Для поддерживающей терапии р-адреноблокаторы назначают внутрь. Стойкий терапевтический эффект развивается спустя 3−6 сут.
Эсмолол используют в кардиохирургии. Этот р-адреноблокатор ослабляет негативные реакции на интубацию и экстубацию трахеи, купирует периоперационную суправентрикулярную тахикардию. При операциях на работающем сердце без искусственного кровообращения (аортокоронарном шунтировании) эсмолол, снижая ЧСС (до 50 в минуту) и среднее АД (менее 80 мм рт.ст.), предупреждает развитие послеоперационного кровотечения, сводит к минимуму риск ишемии миокарда в момент пережатия коронарной артерии.
При синдроме Вольффа-Паркинсона-Уайта р-адреноблокаторы противопоказаны, так как они не влияют на скорость проведения потенциалов действия в дополнительных путях, что усиливает антидромную суправентрикулярную тахикардию.
Фармакокинетика, побочное действие и противопоказания к применению р-адреноблокаторов описаны в лекции 12. р-Адреноблокаторы оказывают минимальное аритмогенное действие.
II класс — блокаторы калиевых каналов, удлиняющие эффективный рефрактерный период Основное средство этой группы — аналог тиреоидных гормонов амиодарон. Это производное бензофурана содержит 37% йода в молекуле, взаимодействует с рецепторами тиреоидных гормонов в ядре клеток, как липофильное вещество изменяет функции липидного микроокружения ионных каналов.
Амиодарон обладает широким спектром антиаритмической активности при суправентрикулярных и желудочковых тахиаритмиях.
• Замедляет спонтанную деполяризацию в фазе 4 (блокирует кальциевые и инактивированные натриевые каналы).
Ослабляет аритмогенное действие трийодтиронина.
Амиодарон снижает ЧСС, замедляет проведение потенциалов действия в предсердиях, атриовентрикулярном узле, системе Гиса-Пуркинье и дополнительных путях, не нарушает сократимости миокарда, расширяет коронарные сосуды (неконкурентно блокирует а-адренорецепторы), снижает потребность сердца в кислороде, способствует сохранению его энергетических ресурсов (блокирует р-адренорецепторы), вызывает умеренную артериальную гипотензию. К амиодарону более чувствительны предсердия, поэтому при суправентрикулярных аритмиях действие наступает быстрее.
Амиодарон плохо всасывается из кишечника и подвергается интенсивной пресистемной элиминации (биодоступность — 20−40%).
Концентрация амиодарона в миокарде выше, чем в плазме, в 20 раз, в жировой ткани — в 300 раз. Антиаритмический эффект развивается только после накопления амиодарона в миокарде через 2−3 сут, максимум — через 8−12 нед. Для достижения быстрого лечебного действия амиодарон вводят внутривенно капельно в насыщающей дозе в течение 24 ч. Поддерживающие дозы составляют примерно половину насыщающих доз.
Более 95% молекул амиодарона связано с белками плазмы. В печени амиодарон подвергается деэтилированию изоферментом 3А4 в метаболит, обладающий такой же, как амиодарон, антиаритмической активностью. Основное количество (90%) амиодарона выводится с желчью. Период полуэлиминации составляет 28−30 сут. После отмены антиаритмический эффект сохраняется на протяжении 10−150 сут.
Амиодарон является сильным ингибитором изоферментов 2С9 и 3А4, а также тормозит экскрецию многих лекарственных средств в почках.
Амиодарон вводят в вену и принимают внутрь при синусовой тахикардии, трепетании предсердий, пароксизмальной и персистирующей (>7 сут) формах фибрилляции предсердий, тахикардии из атриовентрикулярного узла (пароксизмальной суправентрикулярной тахикардии), синдроме ВольффаПаркинсона-Уайта, желудочковой тахикардии и экстрасистолии, в том числе у больных гипертрофической кардиомиопатией и тяжелой сердечной недостаточностью, в постинфарктном периоде, после кардиохирургических операций. У пациентов с имплантированным кардиовертером-дефибриллятором амиодарон снижает частоту разрядов, не влияя на их порог, препятствует суправентрикулярной аритмии. Редко амиодарон применяют как антиангинальное средство для курсовой терапии стенокардии.
Достоинства амиодарона — возможность назначения при аритмии у больных инфарктом миокарда и сердечной недостаточностью, редкое развитие аритмогенного эффекта, отсутствие синдрома отдачи после прекращения терапии.
При кратковременном применении амиодарон нетоксичен. У 1752% пациентов, длительно принимавших амиодарон, возникают побочные эффекты: брадикардия, артериальная гипотензия, тошнота, тремор, атаксия, гипоили гиперфункция щитовидной железы, обострение бронхиальной астмы, фотодерматоз (у 5% людей появляется серо-голубое окрашивание открытых участков кожи), нарушения зрения (радужный нимб по периферии поля зрения, изредка — катаракта из-за отложения липофусцина в хрусталике). Описаны редкие случаи альвеолита, фиброза легких и цирроза печени, обусловленные образованием свободных радикалов кислорода под влиянием амиодарона, принятого в дозе, превышающей 400 мг/сут.
Амиодарон противопоказан при брадикардии (ЧСС — менее 60 в минуту), беременности и грудном вскармливании. Его назначают с осторожностью при атриовентрикулярной блокаде, бронхиальной астме и заболеваниях щитовидной железы.
Антиаритмическими средствами III класса являются также соталол и нибентан.
Соталол представляет собой оптически неактивную смесь изомеров. Из них L-изомер блокирует радренорецепторы сильнее D-изомера. Оба энантиомера, нарушая калиевый ток задержанного выпрямления, замедляют реполяризацию в фазе 2 и удлиняют ЭРП. Соталол уменьшает ЧСС и замедляет проведение потенциалов действия в атриовентрикулярном узле.
Соталол не связывается с белками плазмы и элиминируется в неизмененном виде почками. Период полуэлиминации — 7−15 ч. Применяется при сочетании фибрилляции или трепетания предсердий и желудочковых тахиаритмий, эффективен при аритмии на фоне ИБС.
Соталол на фоне гипокалиемии может вызывать желудочковую тахикардию типа «пируэта». Другие его побочные эффекты обусловлены блокадой р-адренорецепторов. При прекращении терапии соталолом может развиваться синдром отдачи.
Нибентан* удлиняет ЭРП и проявляет антихолинергические свойства. Он умеренно снижает ЧСС и сердечную проводимость. Оказывает антиаритмическое действие при трепетании и фибрилляции предсердий, тахикардии из атриовентрикулярного узла (пароксизмальной суправентрикулярной тахикардии), желудочковой тахикардии, синдроме Вольффа-Паркинсона-Уайта. У пациентов с суправентрикулярной и желудочковой экстрасистолией нибентан* менее эффективен и может вызывать желудочковую тахикардию типа «пируэта». Нибентан* рекомендуют для внутривенного введения в специализированных кардиологических отделениях при условии мониторного контроля сердечного ритма. Побочное действие нибентана* характеризуется появлением кислого или металлического привкуса во рту, чувством жара или холода, двоением в глазах, легким головокружением, першением в горле.
Ш класс — блокаторы кальциевых каналов Ионы кальция участвуют во многих физиологических процессах: сокращении миокарда, гладких мышц кровеносных сосудов и внутренних органов, скелетных мышц, выделении медиаторов и гормонов, секреции продуктов экзокринных желез, агрегации тромбоцитов, делении клеток. Ионы кальция выполняют функции вторичных мессенджеров, регулируя сопряжение потенциала действия и эффекта. Кальциевый гомеостаз является необходимым условием нормальной деятельности всех клеток.
Различают рецепторои потенциалозависимые кальциевые каналы цитоплазматической мембраны. Рецепторозависимые каналы открываются при активации рецепторов, например агадренорецепторов, нхолинорецепторов, NMDA-рецепторов. Потенциалозависимые кальциевые каналы открываются при деполяризации мембраны. Вход в клетки ионов кальция служит пусковым механизмом для выделения этих ионов из внутриклеточных депо.
Потенциалозависимые кальциевые каналы имеют белковую структуру и состоят из а!-, а2-, ри Y-субъединиц. Потенциалочувствительным сенсором служит агсубъединица. Данную субъединицу блокируют лекарственные средства.
Выделяют 5 типов потенциалозависимых кальциевых каналов (табл. 34−3).
Таблица 34−3. Локализация и функции потенциалозависимых кальциевых каналов и их специфические блокаторы.
Тип. | Локализация. | Функция. | Вещества-блокаторы. | |
Ь. | Кардиомиоциты. | Сокращение. | Верапамил, дилтиазем. | |
т. | Гладкие мышцы. | Сокращение. | Нифедипин1 | |
Ь п. | Нейроны. | ю-Конотоксин2 | ||
Т. | Синусный и атрио; | Поддержание деполяризации мембраны. | Мибефрадил2 | |
т. | вентрикулярный. | |||
узлы. | ||||
Т п. | Нейроны головного мозга. | Пейсмейкерная активность, передача потенциалов действия. | Этосуксимид Вальпроевая кислота3Циннаризин. | |
N. | Нейроны. | Выделение медиаторов. | Амилорид2 | |
Р. | Клетки Пуркинье мозжечка. | Передача потенциалов действия. | А-аперта2 | |
Я. | Эндотелий сосудов. | Секреция N0 и эндотелина-1. | Исрадипин2 | |
Первые блокаторы кальциевых каналов прениламин и верапамил были синтезированы в 1961 г. в лаборатории фармацевтической фирмы «Knoll» (ФРГ). Вскоре Хасс и Хартфелдер установили, что эффективный вазодилататор верапамил оказывает отрицательное инотропное действие на сердце. В 1967 г. Альбрехт Флекенштейн и соавт. открыли зависимость действия верапамила на сокращения изолированных сосочковых мышц сердца от концентрации ионов кальция. Кардиодепрессивный эффект верапамила утрачивался после удаления ионов кальция из перфузирующего раствора, но восстанавливался после добавления этих ионов. В 1969 г. Флекенштейн создал блокатор кальциевых каналов гладких мышц нифедипин.
В кардиологии применяют блокаторы кальциевых каналов L-типа (от англ. long-lasting). Блокатор кальциевых каналов сердца производное фенилалкиламина верапамил оказывает антиаритмический, анти-ангинальный и антигипертензивный эффекты. Блокаторы кальциевых каналов артерий и блокатор кальциевых каналов сердца и артерий дилтиазем применяют как антиангинальные и гипотензивные средства.
Верапамил блокирует открытые кальциевые каналы миокарда (в миокарде высокая частота потенциалов действия и длительное открытое состояние кальциевых каналов). Он обладает следующими механизмами антиаритмического действия.
Производное 1,4-дигидропиридина нифедипин рассмотрен в лекциях 37 и 38.
В медицинской практике не применяются.
Противоэпилептические средства рассмотрены в лекции 21.
- • Замедляет развитие потенциалов действия в синусном и атриовентрикулярном узлах (фаза 0).
- • Удлиняет ЭРП, нарушая вход ионов кальция в фазе 2 реполяризации.
- • Повышает порог поздней следовой деполяризации.
- • Препятствует циркуляции волны возбуждения в атриовентрикуляном узле.
Преимущественное влияние верапамила на синусный узел, предсердия и атриовентрикулярный узел обусловлено электрофизиологическими свойствами этих отделов сердца. В синусном узле и предсердиях потенциалы действия обусловлены входом ионов кальция, в атриовентрикулярном узле — входом ионов кальция и натрия, в системе Гиса-Пуркинье желудочков возникают натриевые потенциалы.
Верапамил снижает ЧСС, тормозит проведение потенциалов действия, ликвидирует гипоксию миокарда, так как снижает его потребность в кислороде и улучшает коронарный кровоток.
Верапамил принимают внутрь и вводят внутривенно. Он хорошо всасывается из кишечника, но подвергается интенсивной пресистемной элиминации, поэтому биодоступность составляет только 10−30%. При длительном применении она возрастает. При приеме внутрь пик концентрации в плазме обнаруживается через 1 -3 ч, постоянная концентрация устанавливается спустя 4 сут. Около 90% молекул связано с белками плазмы. Верапамил быстро подвергается N-деалкилированию и О-деметилированию в печени при участии CYP3A4, CYP3A5 и CYP3A7. Образует активный метаболит — норверапамил. Выводится с мочой (70% дозы, из них 3−5% в неизмененном виде) и желчью (16−25%). Период полуэлиминации составляет при однократном приеме 3−7 ч, при повторном введении — 4,5−12 ч.
Верапамил назначают при фибрилляции предсердий и пароксизмальной реципрокной атриовентрикулярной тахикардии, а также при стабильной стенокардии и артериальной гипертензии.
Побочное действие верапамила незначительно. Иногда он вызывает головокружение, чувство усталости, аллергические реакции, запор атонического характера. В больших дозах верапамил вызывает брадикардию, существенно нарушает атриовентрикулярную проводимость, снижает АД.
Верапамил противопоказан при брадикардии, синдроме слабости синусного узла, кардиогенном шоке, выраженной артериальной гипотензии, инфаркте миокарда с атриовентрикулярной блокадой, синдроме Вольффа-Паркинсона-Уайта с антидромной желудочковой тахикардией, в первые 3 мес беременности и при кормлении грудным молоком.
Другие антиаритмические средства Аденозин — естественный нуклеозид, медиатор пуринергических синапсов. В сердце активирует метаботропные А-трецепторы, ассоциированные через G-белки с аденилатциклазой, кальциевыми и калиевыми каналами. Снижает активность аденилатциклазы и синтез цАМФ, тормозит вход ионов кальция и повышает выход ионов калия в предсердиях, синусном и атриовентрикулярном узлах. Вызывает гиперполяризацию и подавляет автоматизм эктопических очагов. Уменьшение кальциевой проводимости удлиняет рефрактерный период атриовентрикулярного узла и подавляет поздние следовые потенциалы.
Аденозин снижает ЧСС и атриовентрикулярную проводимость. Расширяет аорту и каротидный синус, что может вызывать преходящую симпатическую активацию из-за ослабления барорефлекса.
Антиаритмическое средство аденозина фосфат быстро поступает в эритроциты и эндотелий сосудов, где инактивируется аденозиндезаминазой. Период полуэлиминации — менее 10 с. Необходимо быстрое вливание болюса в центральную вену, чтобы аденозина фосфат успел поступить в сердце прежде, чем подвергнется элиминации. Показан при пароксизмах суправентикулярной тахикардии, вызванной круговой волной возбуждения, для купирования желудочковой тахикардии, обусловленной поздней следовой деполяризацией. Аденозина фосфат используют для диагностики коронарных синдромов, управляемой артериальной гипотензии во время хирургических операций.
Действие аденозина фосфата усиливается при одновременном приеме дипиридамола (ингибитора аденозиндезаминазы и захвата аденозина клетками), у пациентов с пересаженным сердцем (вследствие денервационной гиперчувствительности). Метилксантины (кофеин, теофиллин, теобромин), блокируя А-т рецепторы, ослабляют антиаритмический эффект аденозина фосфата. Это необходимо учитывать при терапии больных, которые употребляют чай и кофе.
Преимущество аденозина фосфата перед другими антиаритмическими средствами — кратковременные побочные эффекты из-за быстрой элиминации. Возможны асистолия в течение 5 с, фибрилляция предсердий, желудочковая тахикардия типа «пируэта», артериальная гипотензия, покраснение лица, головокружение, чувство сдавления и жжения в грудной клетке, одышка, бронхоспазм. Аденозина фосфат противопоказан при слабости синусного узла, атриовентрикулярной блокаде М-Ш степени. Его введение не рекомендуется больным инфарктом миокарда, так как возникает опасность синдрома коронарного обкрадывания.
Магний блокирует кальциевые каналы, контролирует внутриклеточное содержание ионов калия, активность Ыа+, К±зависимой АТФазы и Са2±зависимой АТФазы, процессы биоэнергетики. Ослабляет аритмогенное действие сердечных гликозидов. Улучшает коронарный кровоток, оказывает кардиопротективное влияние, снижает постнагрузку, АД и агрегацию тромбоцитов.
Магния сульфат вводят внутривенно в дозе 1−2 г для купирования эпизодов желудочковой тахикардии типа «пируэта» с удлиненным интервалом О-Т, аритмии при гликозидной интоксикации. Антиаритмическое действие проявляется у пациентов с нормальным содержанием ионов магния в крови.
Внутривенное введение магния сульфата может вызывать угнетение дыхания и шок вследствие гипермагниемии (антидот — кальция хлорид). Противопоказания к применению — синоатриальная и атриовентрикулярная блокада.
Мочегонные средства Мочегонные средства (диуретики) оказывают прямое влияние на функциональное состояние нефронов и повышают натрийурез и диурез. Их применяют для лечения отечного синдрома и артериальной гипертензии, ускорения элиминации ядов при отравлениях.
Задержка солей и воды в организме с увеличением гидратации тканей, образованием отеков и скоплений жидкости в полостях сопровождает многие заболевания почек, печени, сердечно-сосудистую недостаточность, гормональные дисфункции. Соли и вода быстро перемещаются из сосудистого русла в интерстициальную жидкость (общая поверхность капиллярных стенок составляет 20 000 м2) и затем в клетки.
Далеко не все лекарственные средства, увеличивающие диурез, относятся к группе мочегонных средств. Например, мочегонный эффект вызывают лекарственные средства, улучшающие кровоснабжение почек в результате усиления сердечных сокращений (сердечные гликозиды) или расширения почечной артерии (вазодилататоры). Эти средства применяют для устранения отеков при сердечной недостаточности.
В почках находится около 1 млн нефронов, в которых происходят фильтрация, реабсорбция и секреция.
В сосудистых клубочках плазма крови фильтруется через мембраны капилляров и капсулы нефрона со скоростью 120 мл/мин. Через поры мембран проходят почти все компоненты плазмы, за исключением белков с большой молекулярной массой, веществ, связанных с белками, и высокомолекулярных липидов.
В проксимальных извитых канальцах из фильтрата реабсорбируется 65% №+, также возвращаются в кровь К+, 70% Са2+, 20−25% Мд2+, ионы хлора, бикарбоната, 80% фосфатов, аминокислоты, глюкоза, витамины, по осмотическому градиенту всасывается вода. Первичная моча в конечном отделе проксимальных канальцев напоминает простой раствор натрия хлорида, изоосмотический интерстициальной жидкости и плазме крови. В среднем сегменте проксимальных канальцев расположены системы секреции органических кислот (мочевая, п-аминогиппуровая кислоты, тиазиды, тиазидоподобные, сильнодействующие мочегонные средства, антибиотики группы р-лактамов). В начальном и конечном сегментах секретируются органические основания (креатинин, холин, прокаинамид). В механизмах секреции участвуют белки-транспортеры органических анионов (кислот) и катионов (оснований).
В нисходящем колене петли нефрона вода по осмотическому градиенту реабсорбируется в гиперосмотический мозговой слой почки. Первичная моча становится гиперосмотической.
В тонком сегменте восходящего колена петли реабсорбируются №+, С1- и мочевина.
В толстом сегменте восходящего колена петли реабсорбируются 25% №+, К+, 25% Са2+, 70−75% Мд2+, С1-. Первичная моча становится сначала изоосмотической, а затем, по мере продвижения по восходящему колену и всасывания ионов, приобретает гипоосмотический характер. При этом интерстициальная жидкость мозгового слоя становится гиперосмотической, что необходимо для реабсорбции воды в нисходящем колене.
В дистальных извитых канальцах реабсорбируются №+, Са2+, 5% Мд2+, С1- без поступления в кровеносное русло воды, секретируются К+ и Н+. Первичная моча сохраняет гипоосмотичность, установившуюся в восходящем колене петли.
В реабсорбции ионов в дистальных извитых канальцах участвуют гормоны:
- • минералокортикоид альдостерон — повышает реабсорбцию №+ и стимулирует секрецию К+ и Н+;
- • паратиреоидин — увеличивает реабсорбцию Са2+ через каналы апикальной мембраны и обмен Na+/Ca2+ в базолатеральной мембране.
В собирательных трубочках под влиянием вазопрессина (АДГ) реабсорбируется вода в гиперосмотическую среду мозгового слоя почки, в корковом сегменте продолжаются зависимые от альдостерона реабсорбция №+, секреция К+ и Н+, во внутреннем мозговом отделе реабсорбируется мочевина. Моча становится гиперосмотической.
Образование мочи регулируется канальцево-клубочковой обратной связью при участии плотного пятна. Оно расположено в месте контакта толстого сегмента восходящего колена петли нефрона с приносящей артериолой клубочка и состоит из эпителиальных клеток, чувствительных к концентрации NaCl в первичной моче. Повышенная концентрация стимулирует секрецию аденозина. Этот медиатор, суживая приносящую артериолу клубочков при участии Агрецепторов, ограничивает фильтрацию. Кроме того, плотное пятно регулирует секрецию ренина юкстагломерулярными клетками, также расположенными в стенке приносящей артериолы.
Мембраны нефроцитов выполняют различные функции.
- • Апикальная (люменальная) мембрана — обращена в просвет канальцев и контактирует с первичной мочой.
- • Базальная мембрана — обращена к межклеточному пространству и контактирует с интерстициальной жидкостью.
- • Латеральные мембраны — создают межклеточные щели в почечных канальцах.
Типы транспорта веществ в почках.
Пассивный транспорт С помощью пассивного транспорта в нефронах происходят:
- • фильтрация воды через поры клеток и по межклеточным щелям в среду с более высоким осмотическим давлением;
- • простая диффузия липофильных молекул через клеточные мембраны по градиенту концентрации;
- • диффузия ионов через ионные каналы по электрохимическому градиенту;
- • облегченная диффузия (унипорт) ионов по электрохимическому градиенту с участием белковтранспортеров;
- • симпорт (котранспорт) — облегченная диффузия катиона и аниона в одном направлении при участии общего белка-транспортера (симпортера);
- • антипорт (противотранспорт) — облегченная диффузия ионов с одинаковым зарядом в противоположных направлениях при участии общего белка-транспортера (антипортера).
Системы симпорта и антипорта функционируют в апикальной и базолатеральной мембранах нефроцитов. В процессе симпорта катионы №+ проходят через апикальную мембрану по электрохимическому градиенту и, нейтрализуя отрицательный заряд внутри клеток, создают условия для входа &-, НСО3-, аминокислот, глюкозы. Анионы поступают по электрохимическому градиенту через базолатеральную мембрану в интерстициальную жидкость, снижают ее положительный заряд, что облегчает выход №+.
Для антипорта необходимо снижение положительного заряда первичной мочи после поступления №+ в нефроциты через апикальную мембрану. В результате образуется электрохимический градиент для выхода Н+ в просвет канальцев. В базолатеральной мембране происходит первичный транспорт анионов НСО3- по электрохимическому градиенту в интерстициальную жидкость, сопряженный с входом в нефроциты ^- (рис. 35−1).
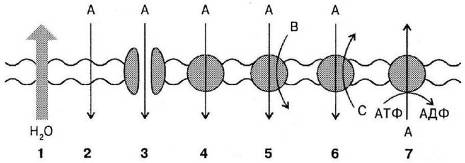
Рис. 35-1. Механизмы реабсорбции в почечных канальцах. 1 — фильтрация воды; 2 — простая диффузия липофильных веществ; 3 — транспорт ионов; 4 — облегченная диффузия; 5 — симпорт; 6 — антипорт; 7 — активный транспорт
Активный транспорт Через базолатеральную мембрану нефроцитов происходит активный транспорт.
- • Удаление 3№+ против электрохимического градиента в интерстициальную жидкость в обмен на возврат в клетки 2К+ при участии №+, К±зависимой АТФазы.
- • Удаление Са + и Мд + при участии соответственно Са ± и Мд ±зависимой АТФазы.
Ионные насосы базолатеральной мембраны создают электрохимический градиент для пассивной диффузии ионов через апикальную мембрану нефроцитов. Энергетические потребности для осуществления активного транспорта в корковом слое почек обеспечиваются реакциями окислительного фосфорилирования (почки потребляют 10% кислорода, поступающего в организм); в мозговом слое энергию поставляет анаэробный гликолиз.
Мочегонные средства увеличивают фильтрацию первичной мочи в клубочках и подавляют реабсорбцию ионов и воды в канальцах. Диурез наиболее эффективно повышается в результате торможения канальцевой реабсорбции.
- • гидруретики, вызывающие преимущественно водный диурез, — осмотические диуретики;
- • салуретики, первично подавляющие реабсорбцию ионов, — ингибиторы карбоангидразы, сильнодействующие диуретики, тиазиды, тиазидоподобные и калийсберегающие диуретики.
По локализации мочегонного действия в нефроне различают:
- • диуретики, преимущественно увеличивающие фильтрацию в клубочках, — диметилксантины;
- • диуретики, подавляющие реабсорбцию:
- — в проксимальных извитых канальцах — ингибиторы карбоангидразы;
- — в петле нефрона — осмотические диуретики;
- — в толстом сегменте восходящего колена петли нефрона — сильнодействующие диуретики (ингибиторы симпорта №±К±2С1-);
- — в дистальных извитых канальцах — тиазиды, тиазидоподобные диуретики (ингибиторы симпорта №±С1-);
- — в дистальных извитых канальцах и корковом сегменте собирательных трубочек — калийсберегающие диуретики.
По силе мочегонного действия (в скобках указана экскретируемая фракция ионов натрия) диуретики разделяют:
- • на сильные диуретики — сильнодействующие диуретики (15−25%);
- • диуретики средней силы — осмотические диуретики (5−8%), тиазиды, тиазидоподобные диуретики (5−10%);
- • слабые диуретики — диметилксантины, ингибиторы карбоангидразы, калийсберегающие диуретики (3−5%).
По скорости наступления и продолжительности мочегонного действия выделяют:
- • диуретики, вызывающие быстрый и непродолжительный мочегонный эффект, — осмотические и сильнодействующие диуретики;
- • диуретики со средней скоростью и продолжительностью действия — диметилксантины, ингибиторы карбоангидразы, тиазиды, калий-сберегающие диуретики (триамтерен);
- • диуретики с отсроченным и продолжительным мочегонным эффектом — тиазидоподобные диуретики, калийсберегающие диуретики (антагонисты альдостерона).
По влиянию на кислотно-щелочное равновесие крови различают:
- • диуретики, вызывающие выраженный метаболический ацидоз, — ингибиторы карбоангидразы;
- • диуретики, вызывающие умеренный метаболический ацидоз, — калийсберегающие диуретики;
- • диуретики, вызывающие умеренный метаболический алкалоз, — сильнодействующие диуретики, тиазиды, тиазидоподобные диуретики.
По влиянию на экскрецию ионов калия выделяют:
- • сильные калийуретики (диурез/калийурез = 1/1) — ингибиторы карбоангидразы, тиазиды, тиазидоподобные диуретики;
- • малые калийуретики (диурез/калийурез = 1/0,25) — осмотические диуретики;
- • калийсберегающие диуретики.
По влиянию на экскрецию ионов кальция различают:
- • диуретики, повышающие экскрецию Са2+, — сильнодействующие диуретики;
- • диуретики, снижающие экскрецию Са2+, — тиазиды, тиазидоподобные диуретики.
Влияние диуретиков на экскрецию ионов, мочевой кислоты и гемодинамику почек представлено в табл. 35−1, 35−2.
Таблица 35−1. Влияние диуретиков на экскрецию ионов и мочевой кислоты.
Группа диуретиков. | N3'. | к. | н. | Са2 | мё2+ | С1. | НСОз. | НРО 2 | Мочевая кислота. | ||
одн. | длит. | ||||||||||
Ингибиторы карбоангидразы. | т. | п. | і. | -; | -; | Т. | тт. | п. | В. | ||
Группа диуретиков. | к. | н. | Са2 | С1; | нсог | НРО 2 | Мочевая кислота. | ||||
одн. | длит. | ||||||||||
Осмотические. | гг. | т. | в. | Г. | п. | г. | т. | Т. | Т. | В. | |
Сильнодействующие. | ттт. | Г1 | т. | тт. | тт. | тт. | ^2. | т. | |||
Тиазиды. | п. | п. | т. | і. | г. | г. | г. | т. | т. | ||
Антагонисты алъдостерона. | т. | і. | ; | т. | -; | в. | в. | ||||
Триамтерен. | г. | і. | т. | -; | ; | в. | |||||
Примечания: | - повышение; |- понижение;—отсутствие изменений; В — действие вариабельное;
Таблица 35−2. Влияние диуретиков на гемодинамику почек и клубочковую фильтрацию.
Группа диуретиков. | Почечный кровоток. | Скорость гломерулярной фильтрации. | Фильтруемая Фракция крови. | Канальцево-клубочковая обратная связь. | |
Ингибиторы карбоангидразы. | -; | ||||
Осмотические. | т. | В. | |||
Сильнодействующие. | В. | В. | |||
Тиазиды. | -; | В. | В. | ; | |
Антагонисты альдостерона. | -; | -; | -; | ; | |
Триамтерен. | -; | ; | ; | ; | |
— за исключением торасемида; - только для диуретиков, содержащих сульфонамидную группу; одн. — однократное применение; длит. — длительное применение.
Мочегонные средства, увеличивающие фильтрацию Диметилксантины К диметилксантинам относят:
- • теофиллин — 1,3-диметилксантин;
- • аминофиллин — растворимая форма теофиллина, в состав входит 80% теофиллина и 20% этилендиамина;
- • теобромин — 3,7-диметилксантин.
В качестве мочегонного средства применяют препарат теофиллина аминофиллин. Теофиллин, блокируя А1— рецепторы аденозина, устраняет их угнетающее влияние на активность аденилатциклазы и синтез цАМФ. В больших дозах теофиллин ингибирует изоферменты фосфодиэстеразы III, IV, V и задерживает инактивацию циклических нуклеотидов. Таким образом под влиянием аминофиллина в клетках накапливается цАМФ.
Аминофиллин оказывает слабое мочегонное действие (повышает экскрецию №+ до 3−5%) с помощью нескольких механизмов.
- • Повышает кровоснабжение почек, поскольку усиливает сердечную деятельность и расширяет почечную артерию.
- • Подавляет реабсорбцию №+ в проксимальных канальцах в результате ингибирования под влиянием цАМФ симпорта через базолатеральную мембрану.
Аминофиллин принимают внутрь и вводят внутривенно при недостаточности левого желудочка, артериальной гипертензии, нарушениях мозгового кровообращения, а также комбинируют с мочегонными средствами, ухудшающими почечный кровоток. Мочегонный эффект после введения в вену развивается через 15−30 мин и длится 2−3 ч.
При приеме внутрь аминофиллин может вызывать диспепсические расстройства. При его быстром внутривенном введении иногда возникают головокружение, головная боль, сердцебиение, тошнота, рвота, судороги, артериальная гипотензия. При сенсибилизации к этилендиамину возможны развитие эксфолиативного дерматита и появление лихорадки.
Аминофиллин противопоказан при значительной артериальной гипотензии, пароксизмальной тахикардии, экстрасистолии, стенокардии, инфаркте миокарда, эпилепсии.
сердечный гликозид кардиотонический.