Моделирование активности головного мозга на основе модели Ходжкина-Хаксли

Особое внимание привлекает принцип конкурентного ингибирования, напрямую связанный с нейросетевыми моделями головного мозга. Кора головного мозга включает около 20% ингибирующих интернейронов, предотвращающих взрыв активности пирамидальных нейронов, связанных стимулирующими связями (например, при эпилепсии). Из-за конкурентного ингибирования представление информации в нейронной сети мозга… Читать ещё >
Моделирование активности головного мозга на основе модели Ходжкина-Хаксли (реферат, курсовая, диплом, контрольная)
Актуальным трендом современной науки является широкое использование методов математики, информатики и теоретической физики в исследовании биологических систем. Это связано с успехами в понимании живых систем, созданием новых экспериментальных методов, методологическими достижениями в математическом моделировании, ростом производительности вычислительных систем для численных расчетов и моделирования.
До настоящего времени было разработано множество математических моделей нейронных сетей головного мозга, отличающихся сложностью, способом реализации, полнотой, программными и техническими требованиями.
Новые модели нейронных сетей головного мозга (в принципе, любые новые модели) обычно представляют собой комбинацию нескольких имеющихся моделей или их модификацию, т. е. усложнение модели за счет внесения новых переменных и данных.
В XX веке на основе знаний об устройстве нейронных клеток уже строили математическую модель нейронных сетей в виде ориентированного графа (оргграфа), где вершины — нейроны, а связанные нейроны соединяет ориентированное ребро с указанием направления движения сигнала. У данного метода есть свои ограничения на архитектуру вычислительных машин, но существует и другой метод моделирования динамики нейронной сети, оперирующий векторами и матрицами, что дает возможность воспользоваться достоинствами SIMD-архитектуры [1].
Если расширить такую модель до модели с новым параметром, например, синаптическая пластичность нейронной сети, которая отображает способность нейронов менять свои связи, или характеристика вероятности зарождения и затухания нейронных связей, или роста клеток нейронов, или параметр воздействия раздражителя [2], то можно получить модифицированную модель, которая является более сложной и полной. Новые параметры модели должны быть целесообразными и подходящими для решения конкретной задачи.
Модели и методы
За последнее столетие в области нейросетевых моделей когнитивных функций головного мозга были созданы известные модели нейрона и нейросети, заложившие фундамент нейронауки:
- 1) Точечные модели — нейрон представляется в таких моделях как точка без деления на отдельные части, через которую проходят ионные потоки. Примерами точечных моделей являются уравнения Ходжкина-Хаксли, стохастический нейрон.
- 2) Многосегментные модели рассматривают нервную клетку как набор подсистем нейрона, что приближает модель к биологическому строению нейронной клетки. Известные сетевые модели данного класса — персептрон, сеть обратного распространения, сеть Хопфилда, машина Больцмана.
- 3) Феноменологические модели создаются с точки зрения динамики мембранного потенциала нейрона в целом, без детализации. Примерами являются модель интегрирующего или импульсного нейрона (integrate-and-fire), модель ФицХью и Нагумо, модель Ижикевича, пороговый нейрон Мак-Каллока и Питтса.
Вышеописанные нейросетевые модели, в частности, сеть Хопфилда, дали импульс формированию нейросетевой науки. За последнее столетие были разработаны структурные модели, которые были сформированы из нескольких нейронных сетей и имитировали функции определенных систем головного и спинного мозга (префронтальная кора, гиппокамп, базальные ганглии, неокортекс) [3].
В конце XX столетия были сформулированы принципы, на которых должно основываться моделирование активности мозга. Три принципа связаны с архитектурой модели и взаимодействием ее нейроноподобных компонентов, еще два принципа касаются способов обучения. Основным принципом является требование биологического правдоподобия нейросетевой модели.
Основные три архитектурных принципа, на основе которых осуществляется моделирование активности мозга, следующие:
- 1) распределенное представление — означает, что данные хранится одновременно во многих нейронных клетках, а один нейрон является носителем различных данных;
- 2) двустороннее взаимодействие нейронов — принцип основан на двустороннем обмене данными между нейронами и связывает обработку различных информационных каналов в единый целостный процесс;
- 3) конкурентное ингибирование — данное свойство снижает уровень активности нейронных клеток за счет объема активных нейронов в один и тот же момент времени.
При моделировании деятельности головного мозга используются два типа обучения — обучение без учителя (самоорганизация хеббовского типа) и обучение на ошибках типа дельта-правила, т. е. с учителем.
Особое внимание привлекает принцип конкурентного ингибирования, напрямую связанный с нейросетевыми моделями головного мозга. Кора головного мозга включает около 20% ингибирующих интернейронов, предотвращающих взрыв активности пирамидальных нейронов, связанных стимулирующими связями (например, при эпилепсии). Из-за конкурентного ингибирования представление информации в нейронной сети мозга становится разреженным («контрастирование»), благодаря чему данные быстро и эффективно обрабатываются нейронными клетками [3].
Модель Ходжкина-Хаксли — известная и ключевая математическая нейромодель, которая отражает генерацию и распределение потенциалов действия в нейронных клетках. Данная модель применяется также для различных электрически возбуждаемых клеток; например, для мышечных клеток сердца (миоциты), от электрических импульсов которых зависит сердечный ритм. Подобными математическими моделями описываются автоволновые процессы в активных пространствах — самоподдерживающиеся нелинейные волны (т. е. в средах, содержащих распределённые источники энергии). Автоволновые процессы — это такие процессы, в которых малая энергия перемещается волной и нужна для синхронизации или переключения активной среды.
Точечная модель Ходжкина-Хаксли является системой обыкновенных дифференциальных уравнений, которой могут описываться параметры электрического сигнала.
В 1952 году точечная модель была создана Аланом Ллойдом Ходжкином и Эндрю Хаксли для описания электрических механизмов в гигантском аксоне кальмара, которые обеспечивают генерацию и передачу нервного сигнала. В 1963 году авторы модели за данное исследование получили Нобелевскую премию в области физиологии и медицины.
Представим кратко суть модели. Электрический ток Ii, который проходит через ионные каналы, математически описан уравнением:
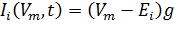
(1).
где gi — проводимость ионного канала, Ei — равновесный потенциал i-го ионного канала, Vm — потенциал мембраны клетки.
Если ионные каналы являются потенциал-зависимы, то канальная проводимость ионного канала gi характеризуется функцией времени и электрического напряжения или потенциала — gn(t, V) для n-го потенциал-зависимого ионного канала, иначе пассивная проводимость выражается константой. Генерируемый ионными транспортерами ток зависит от типа ионов, которые переносятся соответствующим транспортёром.
Модель Ходжкина-Хаксли представляется одним из главных достижений в нейронауке и биофизике XX столетия. Далее модель модифицировалась на основе экспериментальных данных (в уравнение модели были инкорпорированы дополнительные виды ионных каналов и транспортеров) и на данных микроскопии высокого разрешения (добавлены элементы, которые характеризовали сложную морфологию аксонов и дендритов нервных клеток [4].
На основе модели Ходжкина-Хаксли созданы модели, которые описывали двустороннюю активацию и деактивацию в нейросетях и динамику хода потенциала действия.
Модель Ходжкина-Хаксли можно модифицировать, расширять с помощью новых переменных, условий и (или) данных. Например, включить в модель новые дополнительные параметры, возникающие при синапсе у нейрона, а, значит, потенциалов, вызванных нейроном EPSP, возбуждающим ингибиторный постсинаптический потенциал, и IPSP, тормозящим ингибиторный постсинаптический потенциал.
Взаимодействие потенциалов EPSP и IPSP может быть выражено через уравнение баланса токов в ионных каналах калия, натрия и хлора. Данные ионные каналы в наибольшей степени влияют на создание или затухание потенциала покоя.
Ионный канал нейрона является источником ЭДС с определенным потенциалом, а также внутренним сопротивлением из-за серьезной разницы концентрации ионов внутри клетки и за ее пределами.
Ионные каналы нейрона Na+, K+, Cl-, которые проходят через мембрану нервной клетки, влияют на мембранный потенциал нейрона в соответствии со своим значением внутреннего сопротивления.
С учетом вышеизложенного можно представить баланс токов на мембране через проводимости следующим образом, используя модель Ходжкина-Хаксли:
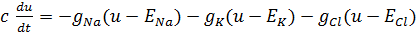
(2).
Где u — общий мембранный потенциал нейрона, c — емкость мембраны, E — ЭДС соответствующих ионных каналов, g — внутренние проводимости соответствующих ионных каналов [5].
Реализация данной модели произведена в среде Matlab.
Модель включает следующие входные параметры (значения берутся на основе доступных экспериментальных данных):
- — емкость мембраны c,
- — реверсный потенциал каждого ионного канала Е, в данном случае их три — натриевый, калиевый и хлора;
- — максимальная проводимость каждого ионного канала g;
- — прикладной ток I;
- — общий потенциал мембраны нейронной клетки u;
- — активационная воротная переменная калиевого канала n (калиевый канал только открывается с повышением потенциала, причем медленно);
- — активационная воротная переменная натриевого канала m;
- — инактивационная воротная переменная натриевого канала h;
- — внутренняя проводимость ионного канала натрия gNa;
- — внутренняя проводимость ионного канала калия gK;
- — внутренняя проводимость канала утечки gl;
- — ток ионного канала натрия INa = gNa (u — ENa);
- — ток ионного канала калия IK = gK (u — EK);
- — ток утечки через неселективные каналы Il = gl (u — El).
При реализации данной модели в среде Matlab использовались четыре вычислительных метода: Рунге-Кутта, ODE45, Эйлера и предиктор-корректор.
Результаты реализации модели баланса токов на мембране в среде Matlab в виде графиков были получены для воротных переменных n, m, h и общего мембранного потенциала u.
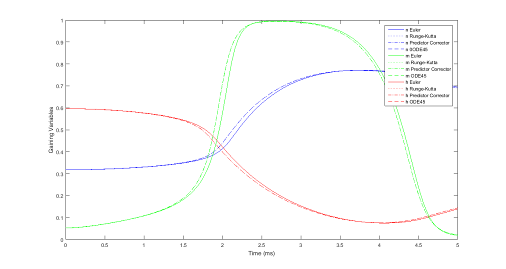
Рисунок 1 Динамика проводимости ионного канала во времени (значения воротных переменных).
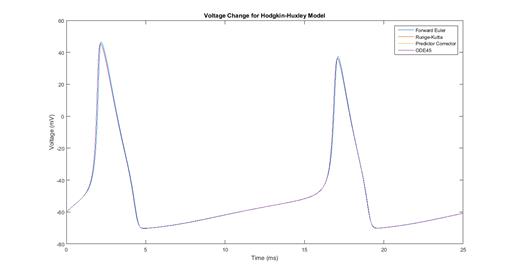
Рисунок 2 Динамика общего потенциала мембраны во времени.
Результаты вычислительного эксперимента показывают, что все методы работают примерно одинаково, и погрешность незначительна. Первый график, приведенный на рисунке 1, отражает динамику проводимости ионного канала во времени (значения воротных переменных). Второй график, представленный на рисунке 2, отражает динамику общего потенциала мембраны во времени, полученную четырьмя методами и показывающий скачкообразный характер изменений u во времени, которые и являются спайками.
При представлении третьей переменной (канал Cl-) как канала утечки L уравнение мембранного потенциала из системы уравнений Ходжкина-Хаксли идентично вышеописанному уравнению баланса токов.
Для исследования явления синапса — процесса взаимодействия нейронов — рассмотрим модификацию данной модели.
Допустим, что кроме ионных каналов Na+, K+, Cl-, на мембране формируются еще два ионных канала после появления синапса у нейронной клетки. Соответственно, появляются EPSP и IPSP, возбуждающий и ингибирующий потенциалы, в синапсе клетки.
В таком случае в уравнение можно включить новые переменные:
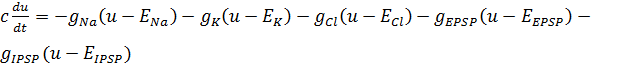
(3).
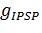
где и — проводимости ионных каналов возбуждающего и ингибирующего потенциалов взаимодействия между нейронами через синапс.
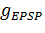
Потоки ионных каналов на мембране и появление синапса схематично представлены на рисунке 3 с позиции системы, состоящей из одного нейрона.
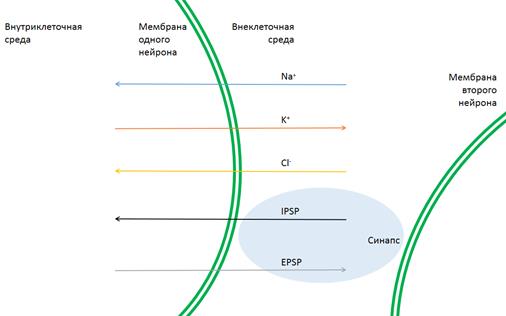
Рисунок 3 Схема мембраны нейрона с ионными потоками и синапсом при контакте с мембраной другой нервной клетки.
Результаты и обсуждение В нейросетевом моделировании активности головного мозга важной задачей является исследование условий, которые влияют на баланс постсинаптических потенциалов, IPSP и EPSP, для предотвращения и устранения активности выше нормы у пирамидальных нейронных клеток, также называемых возбудительными [6]. Необходимо модифицировать определенную существующую модель в рамках данной задачи, добавляя необходимые дополнительные входные параметры.
Было выяснено, что больше всего влияет на возбудительный постсинаптический потенциал, следующий возбуждающий нейромедиатор — глутамат. А на ингибиторный постсинаптический потенциал влияет в большей степени ГАМК, г-аминомасляная кислота, которая относится к тормозным нейромедиаторам.
Подобная проблема в области гиппокампа изучается в лаборатории А. Розова, Шотландия. Лаборатория занимается исследованием проблемы взаимосвязи ингибиторных и возбуждающих нейронных клеток в гиппокампе на основе реакции их рецепторов на нейромедиаторы ГАМК и глутамат [7]. Работа этой лаборатории и исследования вышеназванной проблемы другими учеными является подтверждением актуальности задачи баланса потенциалов EPSP и IPSP в наши дни.
Синапсы могут возникать, исчезать и влиять на значения потенциалов ионных каналов, что называется синаптической пластичностью [8]. Описанное свойство напрямую связано с балансом потенциалов IPSP и EPSP.
Таким образом, баланс потенциалов IPSP и EPSP тесно связан с рекомбинацией синапсов, из которых вытекает еще одно свойство нейрона — рекомбинация связей нейронных клеток.
В этом случае простейшую модель нейронной динамики можно дополнить одним или несколькими характеристиками, перечень которых приведен в [9]. Данный перечень получен авторами статьи в результате анализа существующих моделей, а также методов и способов моделирования нейронных сетей головного мозга.
В рамках поставленной задачи все входные параметры могут быть взяты из доступных баз данных, например, БД каналов различных типов клеток, БД, основанных на отдельном нейроне или на группе нейронов и т. д. (http://bluebrain.epfl.ch/, http://briansimulator.org/, http://www.scholarpedia.org/, др.).
Заключение
В данной работе проведено исследование существующих моделей и принципов в моделировании нейросетевой активности мозга. Рассмотрена модель Ходжкина-Хаксли и проблема изучения равновесия ингибиторного и возбудительного постсинаптических потенциалов IPSP и EPSP, влияющие на такие способности человека, как обучение, память, движение, способность анализировать и т. д. Выполнена реализация модели Ходжкина-Хаксли в среде Matlab. Проведена модификация данной модели для учета возникновения синапса и постсинаптических потенциалов в системе нейрона [10].
Для точечных моделей на основе уравнения Ходжкина-Хаксли могут подойти параметры, более связанные с нейронной клеткой как с единой целой системой, т. е., параметры подсистем нейрона и синапса, например, ионные каналы, мембрана, аксоны, дендриты, рецепторы, везикулы, шипики.
Для феноменологических моделей, созданных на основе уравнения Ижикевича, могут подойти параметры, связанные с группой нейронов или с нейронной сетью: синаптическая пластичность, рекомбинация синапсов, величина постсинаптического ответа, частота активации нейронов, модификации ДНК и другие параметры.
Для исследования баланса потенциалов IPSP и EPSP, основанного на ионных каналах нейрона (а именно, пирамидального) и его синапсах, может быть взята точечная модель [11].
Мозговая активность человека, его способность обучения, анализа, понимания и память, напрямую связана с балансом IPSP и EPSP. При его нарушении происходят сбои в работе мозга — от сложностей в запоминании и обработке информации до эпилептических припадков. Изучение проблемы равновесия ингибиторного и возбудительного постсинаптических потенциалов IPSP и EPSP на основе моделирования является важной научной задачей, имеющей большое практическое значение.
- 1. Савихин С. А., Терентьев А. Б., Дмитриенко Р. М., Климашов В. Ю. Применение высокопроизводительного вычислительного комплекса к анализу информационной динамики нейронных сетей мозга // ISSN 2079;3316 «Программные системы: теория и приложения», N 3(7), 2011, c. 41−52.
- 2. Белоус М. А., Муратова Г. В. Концептуальные положения нейросетевого импульсного моделирования процесса (функции) головного мозга // Материалы XXI научной конференции «Современные информационные технологии: тенденции и перспективы развития» (17−18 апреля 2014, Ростов-на-Дону), с. 51−55.
- 3. Yuan J., Liu L., Hu Q. Mathematical modeling of brain glioma growth using modified reaction-diffusion equation on brain MR images // Computers in Biology and Medicine, № 43, 2013. URL: computersinbiologyandmedicine.com/article/S0010−4825 (13)00274−6/fulltext.
- 4. Романов Д. Е. Нейронные сети обратного распространения ошибки // Инженерный вестник Дона, 2009, № 3 URL: ivdon.ru/ru/magazine/archive/n3y2009/143.
- 5. Анохин М. Н., Березняк С. А., Бланко Л.М. Л. Организация пространственной группировки сигналов в ассоциативных процессах искусственных нейронных сетей // Инженерный вестник Дона, 2014, № 1 URL: ivdon.ru/ru/magazine/archive/n1y2014/2230.
- 6. Ames H., Gorchetchnikov A., Jasmin Leveille A modular framework for computational neuroscience // Neuroinformatics, 6(4):291−309 2008. URL: techlab.bu.edu/resources/software_view/epsp_ipsp/.
- 7. Сазонов В. Ф. Импульсация // Кинезиолог, 2009;2014. URL: kineziolog.bodhy.ru/content/impulsatsiya.
- 8. Стасевич К. Воспоминания сохраняются в нейронах с помощью эпигенетических механизмов // КомпьюЛента, 1997;2016. URL: compulenta.computerra.ru/chelovek/neirobiologiya/10 008 721/.
- 9. Терехин А. Т. Нейросетевое моделирование когнитивных функций мозга: обзор основных идей // Психологические исследования: электрон. журн. 2009. N 2(4). URL: psystudy.ru (дата обращения: 11.10.2014).
- 10. Тикиджи-Хамбурьян Р. А. Лекции по нейроинформатике // XII Всероссийская научно-техническая конференция «Научная сессия НИЯУ МИФИ-2010», г. Москва, 2010, с. 60−62.
- 11. Белоус М. А., Васильков В. А., Муратова Г. В. Параметры моделей нейронных сетей головного мозга // III Международная научная Интернет-конференция «На стыке наук. Физико-химическая серия», том 1, 29 января 2015, с. 40−52.