Механизм гидролиза.
Диссоциация воды и гидролиз солей

II стадия) Возможность для осуществления различных этапов гидролиза не одинакова. Процессу гидролитического взаимодействия по I стадии ничто не препятствует, поэтому он протекает легко: Кр=8,9 • 10−4, и в растворе накапливаются ионы Н+. Процесс электролитической диссоциации воды сдвигается справа налево. Концентрация ионов ОНпонижается. Вероятность столкновения ионов (FeOH)^ с ионами ОНв растворе… Читать ещё >
Механизм гидролиза. Диссоциация воды и гидролиз солей (реферат, курсовая, диплом, контрольная)
Гидролизом называют реакции взаимодействия веществ с водой, приводящие к образованию слабодиссоциирующих веществ: слабых кислот или оснований, кислых или основных солей.
Результат гидролиза можно расценивать как нарушение равновесия диссоциации H2O. Рассмотрим процессы при растворении солей в воде. Соли, как правило, — сильные электролиты, поэтому происходит их полная диссоциация на ионы, которые, в свою очередь, могут взаимодействовать с ионами Н+ или ОНводы.
Следовательно, гидролиз солей протекает за счет взаимодействия ионов соли с водой. Этот процесс—частный случай реакций ионного обмена, когда в качестве реагента выступает вода.
ион вода соль кислота.
Ступенчатый гидролиз многозарядных ионов
В зависимости от катионов и анионов соли можно разбить на ряд групп, различающихся между собой по характеру образующих эти соли кислот и оснований:
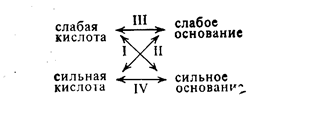
I. Соли слабой одноосновной кислоты и сильного однокислотного основания. Например, растворяется ацетат калия. Являясь сильным электролитом, он полностью диссоциирует на ионы, но вода также частично диссоциирует. Возможно возникновение следующего процесса:
K+ + CH3COO;
H2O OH-+H+.
CH3 COOH.
Так как уксусная кислота — слабый электролит, то при столкновении ее кислотных остатков с ион у ми Н+ воды, образуются недиссоциированные молекулы уксусной кислоты. Удаление из раствора 1цсти ионов Н+ вызывает сдвиг равновесия процесса диссоциации воды слева направо. Содержание ионов ОНв растворе нарастает. Раствор приобретает щелочную реакцию. В ионном виде процесс изображается уравнением В момент достижения равновесия применение закона действия масс приводит к выражению.
Н [H2O] в разбавленных растворах — величина постоянная, поэтому произведение К[H2O] - тоже константа. Ее называют константой гидролиза Кгидр:
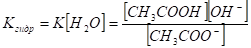
Константу гидролиза можно выразить через ионное произведение воды и константу диссоциации кислоты. Для этого умножим числитель и знаменатель на [H+] и запишем:
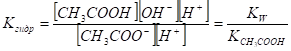
В результате гидролиза число образующихся молекул слабой кислоты равно числу оставшихся от молекул воды несвязанных ионов [ОН-]:
[СН3СООН] = [ОН-].
Концентрация ионов соли практически равна концентрации этой соли, так как сильные электролиты диссоциируют полностью:
[CH3COO-]=CCH3COOK.
где С сн3соок — концентрация соли в растворе.
Подставляем для Кгидр:
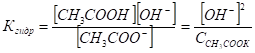
откуда.
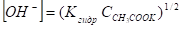
Концентрация ионов гидроксила в растворе соли слабой одноосновной кислоты и сильного однокислотного основания равна квадратному корню из произведения константы гидролиза соли на ее концентрацию. Так как.
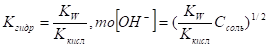
В тех случаях, когда константа диссоциации кислоты очень мала, нельзя пренебрегать в расчете частью ее анионов, связавшейся в недиссоциированные молекулы. В этом случае расчет ведут по более точному выражению.
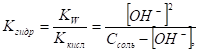
Откуда.
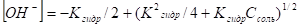
II. Соли сильной одноосновной кислоты и слабого однокислотного основания. Примером такой соля является хлорид аммония. Он сильный электролит и диссоциирует полностью Вода также частично диссоциирует Столкновение ионов NH4+ с ионами ОНприводит к образованию соединения NH4ОH, легко превращающееся в аммиак и воду. Общую схему процесса можно представить уравнением.
или в ионной форме Связывание ионов ОН~ из раствора вызывает сдвиг диссоциации воды слева направо. Концентрация ионов Н+ в растворе растет. Таким образом, гидролиз солей слабых однокислотных оснований и сильных одноосновных кислот создает кислую среду.
Рассуждая аналогично I случаю, получим.
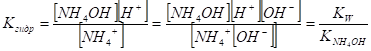
Подставим вместо [NH4ОH] равную ей концентрацию ионов [Н+], а вместо [NH4+] приближенно равную ей концентрацию соли Ссоль.
Получим.
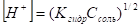
Если образующееся при гидролизе основание очень слабое, то расчет ведут по более точной формуле.
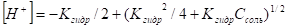
III. Соли слабой одноосновной кислоты и слабого однокислотного основания. При растворении ацетата аммония в воде наступает его практически полная диссоциация:
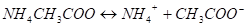
Столкновение ионов NH4+ и СН3СООс молекулами воды приводит к образованию слабо диссоциирующих молекул соответственно слабого основания NH4ОH и слабой кислоты СН3СООН по схеме.
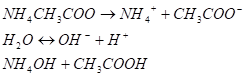
Так как образующиеся вещества—слабые электролиты, то в результате соли слабых кислот и слабых оснований подвергаются почти полному гидролизу, а реакция среды в растворах определяется соотношением силы кислоты и основания. В ионной форме уравнение гидролиза соли может быть представлено уравнением.
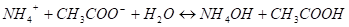
Применим к нему закон действия масс для момента равновесия.
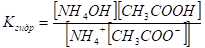
Это выражение можно упростить. Умножим числитель и знаменатель на ионное произведение воды.
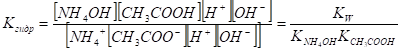
Константы диссоциации основания и кислоты выражаются соответственно.
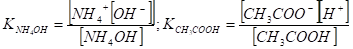
откуда следуют выражения для [N4+] и [СНзСОО-].
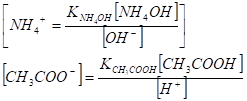
Чтобы получить формулу для расчета [Н+], проведем ряд последовательных преобразований. Из уравнения.
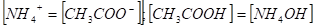
Вместо [NH4ОH] подставим равную ей [СН3СООН], получим.
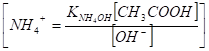
Затем в константу диссоциации кислоты.
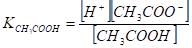
введем вместо [СН3СОО-] равную ей [NН4+], получим.
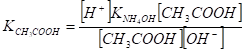
Умножаем числитель и знаменатель соотношения на [Н+] и после сокращения (СН3СООН] и преобразований получим.
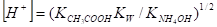
Из формулы видно, что концентрация ионов водорода в растворе соли слабой кислоты и слабого основания не зависит от концентрации раствора соли, а только от соотношения констант диссоциации кислоты и основания.
IV. Соль сильного основания и сильной кислоты. Такая соль в растворе диссоциирует полностью, например хлорид калия В отличие от рассмотренных выше случаев ионы соли — сильного электролита—не могут образовать с водой слабых электролитов, а раз нет взаимодействия с водой, то, следовательно, соли сильных кислот и сильных оснований гидролизу не подвергаются. Среда в растворе остается нейтральной.
Факторы, влияющие на процесс гидролиза.
Соль слабого многокислотного основания и сильной одноосновной кислоты. Например раствор FeCI3 содержит только ионы, так как эта соль в растворе диссоциирует полностью Катион соли представляет собой катион слабого основания, поэтому его столкновение с гидроксильными ионами воды приводит к образованию слабого электролита. Так как вода диссоциирует крайне незначительно, то столкновение ионов Fe3+ с тремя ионами ОН-невероятно. Образование Fе (ОН)3 в результате гидролиза при обычных условиях невозможно. Очевидно, процесс взаимодействия ионов соли с молекулами воды должен протекать по стадиям.
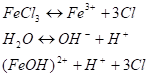
(I стадия) Образовавшийся ион (FeOH)2+ может столкнуться еще с одним ионом ОН;
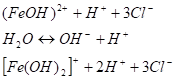
(II стадия) Возможность для осуществления различных этапов гидролиза не одинакова. Процессу гидролитического взаимодействия по I стадии ничто не препятствует, поэтому он протекает легко: Кр=8,9 • 10−4, и в растворе накапливаются ионы Н+. Процесс электролитической диссоциации воды сдвигается справа налево. Концентрация ионов ОНпонижается. Вероятность столкновения ионов (FeOH)^ с ионами ОНв растворе становится незначительной, процесс по II стадии идет гораздо в меньшей степени: Кр=4,9 • 10−7. В итоге II стадии величина ОНстановится еще меньше, и третий эта’п гидролиза становится еще менее вероятным. Практически он самопроизвольно не осуществляется.
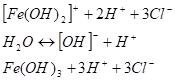
(III стадия) Из уравнений всех трех этапов процесса видно, что ионы С1- участия в реакции не принимают, поэтому влияния на процесс гидролиза не оказывают.
Гидролиз соли многокислотного основания и одноосновной кислоты имеет свои особенности. Процесс протекает по ступеням. При температуре, близкой к комнатной, гидролиз осуществляется практически только по I стадии вследствие накопления в растворе ионов Н+. Соли слабых многоосновных оснований и сильных кислот создают в растворе кислую среду.
Соли слабых многоосновных кислот и сильных оснований. Рассуждая аналогично предыдущему случаю, можно записать для раствора К2СО3:
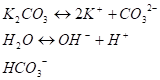
(IV стадия) В результате I стадии гидролиза в растворе накапливаются ионы ОН-, подавляющие процесс диссоциации воды. Поэтому при нормальных условиях II стадия гидролиза становится мало вероятной:
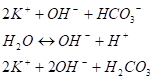
(V стадия) Таким образом, гидролиз солей слабых многоосновных кислот и сильных оснований протекает по стадиям и обычно заканчивается на первой. Раствор соли слабой многоосновной кислоты и сильного основания характеризуется щелочной средой.
Соли слабой многоосновной кислоты и слабого многокислотного основания. Рассуждаем аналогично предыдущим случаям. Для раствора А12(СО3)3 можно записать:
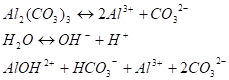
(I стадия) Вторым этапом процесса будет связывание второго иона AL3+ в ион основной соли и еще одного иона СО32- в НСО3-. На I стадии процесса не происходит заметного накопления в растворе ионов ОНи Н+. Поэтому II стадия гидролиза протекает беспрепятственно и оба процесса можно представить суммарным уравнением:
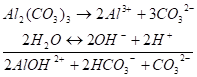
(II и III стадии) И в результате II стадии не возникает заметного сдвига концентраций Н+ или ОНв растворе, поэтому процесс диссоциации воды протекает беспрепятственно и обусловливает возможность течения следующих этапов гидролиза.
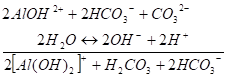
(III и IV стадии) В результате этих стадий не возникло заметного изменения концентраций Н+ 'или ОНв растворе, поэтому возможно продолжение гидролиза.
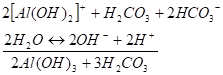
(V и VI стадии) Таким образом, гидролиз солей слабых многоосновных кислот и слабых многокислотных оснований протекает сильнее, чем бинарных солей. В результате гидролиза могут образоваться продукты полного гидролиза соли. Стадия, до которой протекает гидролиз соли, определяется соотношением силы основания и кислоты.
Для характеристики гидролиза различных солей вводятся две величины. Константа гидролиза Кгидр равна в момент динамического равновесия отношению произведения концентраций продуктов гидролиза к произведению концентраций гидролизующихся ионов соли. Стеепень гидролиза? гидр—отношение числа гидролизованных молекул соли к числу растворенных.
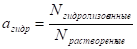
Константы гидролиза соли растут по мере уменьшения констант диссоциации кислот и оснований, образующихся в результате процесса. Следовательно, возрастает и количество гидролизованных молекул. Степень гидролиза соли возрастает по мере уменьшения констант диссоциации кислот и оснований, образующихся в результате процесса.
Пример 1. К раствору FeCL3 добавляют раствор К2СО3. Определить полноту гидролиза.
Решение. Процесс гидролиза раствора FеС13 в сокращенной ионной форме изображается уравнением Последующие стадии процесса не идут.
В растворе К2СО3 гидролиз протекает по схеме.
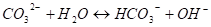
Таким образом, в результате гидролиза в растворах образуются в избытке противоположные по знаку ионы воды (Н+ и ОН-). При смешивании растворов FeCL3 и K2CO3 наступает взаимная нейтрализация ионов Н+ и ОН-. Затруднения для гидролиза по последующим стадиям исчезают, и гидролиз солей слабого основания и сильной кислоты в смеси с солью сильного основания и слабой кислоты идет до конца.
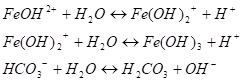
Образование осадка Fе (ОН)3 в результате полного гидролиза FеС1з и непрочной кислоты Н2СО3 облегчает течение процесса. Следовательно, добавление к раствору гидролизующейся соли другой соли, при гидролизе которой создается иная кислотность, усиливает процесс гидролиза.
Разбавление раствора увеличивает вероятность столкновения ионов растворенного вещества с ионами воды, вследствие этого степень гидролиза растет. Константа гидролиза от разбавления раствора не зависит.
При нагревании раствора увеличивается энергия теплового движения и вероятность столкновения ионов соли с ионами воды. Константа диссоциации воды и ее ионное произведение, а, следовательно, степень гидролиза и константа гидролиза растут. Так, процесс гидролиза раствора хлорида железа, протекающий при нормальной температуре до I стадии, при нагревании может проходить по II и даже по III. Это обусловлено увеличением количества ионов FeOH2+, образующихся в результате гидролиза FeCI3 и ростом концентрации ионов ОНв растворе, вследствие увеличения ионного произведения воды. Процессы гидролиза могут быть усилены или подавлены добавлением соединений, содержащих ионы гидроксила или водорода или веществ, подвергающихся гидролизу.
Пример 2. К раствору АеС1з добавляют NH4C1. Определить изменение процесса гидролиза.
Решение. Процесс гидролиза FeCI3 запишется так.
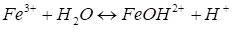
При растворении NH4Cl осуществляется реакция Прибавление хлорида аммония к раствору FeCl3 повышает концентрацию ионов Н+ в растворе. Равновесие смещается влево и гидролиз обеих солей снижается. Таким образом, добавление в раствор гидролизующейся соли другой соли, гидролиз которой сопровождается образованием ионов воды, аналогичных возникающим при гидролизе первой, подавляет гидролиз.