Кремний.
Общая и неорганическая химия

Кремний в природе распространен в виде диоксида Si02, называемого также кремниевым ангидридом, или кремнеземом. Кремнезем встречается в виде песка, кварца. Другую группу природных соединений кремния составляют силикаты — производные кремниевой кислоты. Наиболее распространены алюмосиликаты, к которым относятся полевой шпаг (альбит) NaAlSi308, полевой шпат (ортоклаз) KAlSi308, глина (каолин… Читать ещё >
Кремний. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
Историческая справка Впервые в элементарном виде кремний был получен в 1823 г. выдающимся шведским химиком И. Берцелиусом восстановлением SiF4 металлическим калием.
Кремний — аналог углерода, однако отличается от него меньшей энергией ионизации, большей поляризуемостью атома и наличием вакантных d-орбиталей наружного уровня. Все это обусловливает отличие однотипных соединений кремния по сравнению с углеродом. Координационное число кремния равно 4, 5 и 6, из которых наиболее характерно 4.
Для кремния, как и вообще для элементов третьего периода, рк-рк-свя- зывание нехарактерно, поэтому sp- и 5/?2-гибридные состояния для него неустойчивы. Для него характерно 5/?3-гибридное состояние, поэтому в соединениях он может проявлять степени окисления +4 и -4.
Кремний в природе распространен в виде диоксида Si02, называемого также кремниевым ангидридом, или кремнеземом. Кремнезем встречается в виде песка, кварца. Другую группу природных соединений кремния составляют силикаты — производные кремниевой кислоты. Наиболее распространены алюмосиликаты, к которым относятся полевой шпаг (альбит) NaAlSi308, полевой шпат (ортоклаз) KAlSi308, глина (каолин) Al203-2Si02-2H90, нефелин NaAlSi04 и др.
Кремний получают восстановлением Si02 магнием: 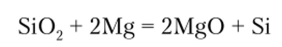 или цинком из SiCl4:
или цинком из SiCl4:
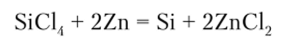
Свойства кремния и его соединений. Кремний образует две аллотропные модификации. В соответствии с sp3— ги приди за ц и ей наиболее устойчива алмазоподобная (кубическая) модификация. Кристаллы этой модификации имеют темно-серый металлический блеск, проводят электрический ток. Аморфный кремний — бурый порошок. Кристаллический кремний химически сравнительно инертен, в то время как аморфный более реакционноспособен.
Кремний реагирует только с сильными окислителями и восстановителями. С фтором протекает реакция уже при обычных условиях, с кислородом и хлором — при 400—600°С. При очень высоких температурах кремний способен непосредственно соединяться с углеродом и азотом:
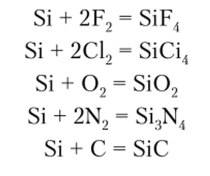
Кремний растворим во многих металлах. С некоторыми из них — Zn, Al, Sn, Pb, Au, Ag — химически не взаимодействует. С другими же металлами, например Mg, Са, Си, Fe, Pt, Bi, реагирует с образованием силицидов:
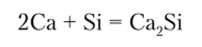
Щелочи взаимодействуют с кремнием, окисляя его до солей кремниевой кислоты. При этих реакциях выделяется и водород:
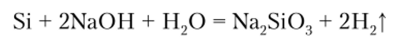
С водой при обычной температуре кремний не взаимодействует, но при высоких температурах протекает реакция.
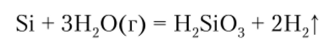
В кислородсодержащих кислотах кремний пассивируется, взаимодействует лишь в смеси HF и HN03:
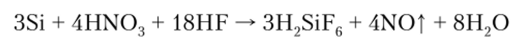
Силициды — соединения кремния с металлами, которые по структуре и свойствам отличаются от карбидов. Тип связи в силицидах изменяется от ионно-ковалентного до металлического. 5-Элементы 1-й и 2-й групп, а также d-элементы 11-й и 12-й групп обладают свойствами полупроводников (полупроводники — вещества, характеризующиеся увеличением электрической проводимости с ростом температуры).
В зависимости от преобладания в силицидах того или иного типа связи свойства их изменяются от металлических к полупроводниковым. Силициды, характеризующиеся высоким содержанием кремния, проявляют высокую кислотои термическую устойчивость, на чем и основано их применение для получения жаростойких и кислотоупорных материалов. В химическом отношении силициды в сравнении с карбидами более инертны. Лишь силициды лития и щелочно-земельных металлов разлагаются водой и кислотами с образованием водорода и смеси силанов:
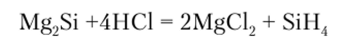
Соединения с водородом (силаны) образуют гомологический ряд общей формулы Si"H2w+2:SiH4, Si2H6, Si3H8, Si4H10 и др.
Поскольку кремний характеризуется меньшей электроотрицателыюстыо, чем углерод, то он не образует очень длинных цепей. Если энергия связи С—С равна 347,69 кДж/моль, то таковая для связи Si—Si равна 174,56 кДж/моль.
Устойчивость силанов уменьшается по мере увеличения числа атомов кремния в молекуле.
Все силаны обладают характерным запахом и очень ядовиты. По сравнению с соответствующими углеводородами они термически менее устойчивы и при нагревании разлагаются:
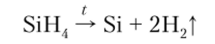
Под действием воды также происходит их разложение: 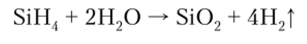
С концентрированной H2S04 силаны нс реагируют. Они легко окисляются до Н20 и SiO.; кислородом, могут самопроизвольно загораться на воздухе:
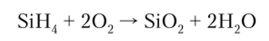
Взаимодействие силана SiH4 с хлором протекает со взрывом:
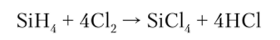
Силан восстанавливает Мп04 до Mn02, Fe3+ до Fe2+, Ag‘ до Ag и т. д.:
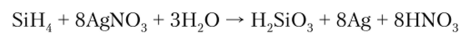
Соединения с галогенами более устойчивы, чем силаны. Тетрафторид SiF4 получают действием концентрированной H2S04 на смесь Si02 и CaF2:
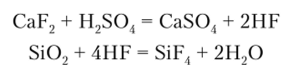
SiCl4 получают действием газообразного хлора на смесь Si02 с углеродом при нагревании:
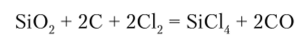
или действием хлора на ферросилиций:
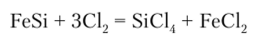
SiF4 — бесцветный газ с резким запахом, a SiCl4 — бесцветная прозрачная жидкость с Ткнп = 57,6°С.
В водных растворах SiF4 и SiCl4 подвергаются гидролитическому расщеплению с выделением соответственно HF и НС1:
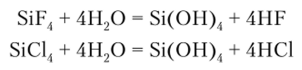
Гидролиз SiCl4 протекает за счет последовательного присоединения молекул воды с последующим отщеплением галогеноводорода вплоть до образования Si (OH)4:
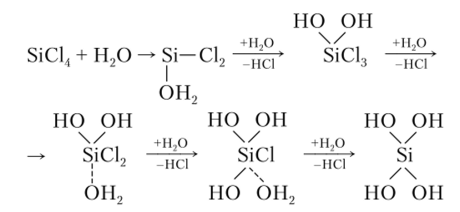
Молекулы Si (OH)4 далее полимеризуются с образованием H2Si03.
Из схемы гидролиза ясно, что координационное число кремния повышается с 4 до 5 при образовании промежуточного соединения, что объясняется возникновением трехцентровой связи.
SiF4 — слабый окислитель, взаимодействуя со щелочными и щелочноземельными металлами, восстанавливается до Si:
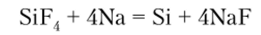
SiF4 отличается от всех остальных галогенидов тем, что его кислотные свойства проявляются не только при гидролизе, но и при взаимодействии с основными фторидами, сопровождающимися образованием гексафторсиликатов: 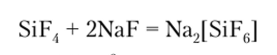
Гексафторсиликат-анион [SiF6]2_ устойчив в водных растворах и соответствует гексафторкремниевой кислоте, которая получается при гидролизе SiF4: 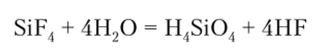
Образующаяся HF далее взаимодействует с еще непрореагировавшим SiF4 с образованием гексафторкремниевой кислоты:
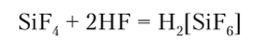
H.;[SiF(.] существует только в водных растворах. Гексафторсиликаты обычно получают действием HF на смесь Si О., и соответствующего фторида по общей схеме.
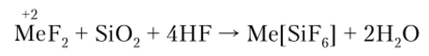
Оксид кремния (1У), или диоксид кремния, Si02 широко распространен в природе в виде модификаций, из которых большое значение имеют кварц (так называемые кварцевые пески, жильный кварц, песчаники), а также кристобалит и тридимитит. Атом кремния в этих минералах всегда окружен по тетраэдру четырьмя атомами кислорода, но связи имеют заметно ионный характер. Эти модификации Si02 отличаются друг от друга характером расположения кремнекислородных тетраэдров в пространстве: кварц и тридимитит имеют гексагональную структуру, а кристобалит — кубическую.
Кремнезем тугоплавок, отличается высокой твердостью и химической стойкостью.
В воде Si02 практически нерастворим. Из кислот на него действует только плавиковая:
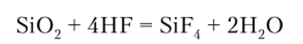
Щелочи взаимодействуют с Si07 с образованием силикатов — солей кремниевой кислоты:
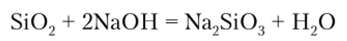
При сплавлении с карбонатами диоксид кремния вытесняет С02, так как С02 более летуч:
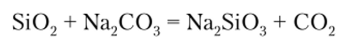
При накаливании смеси Si09 с С до 2000 °C образуется карбид кремния SiC, называемый карборундом: 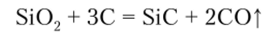
Кремнезем легко переходит в стеклообразное состояние, которое отличается от кристаллических модификаций тем, что в нем тетраэдрические структурные единицы расположены неупорядоченно.
Si02 широко применяется в силикатной промышленности при производстве стекла, керамики, бетонных изделий, силикатного кирпича и др.
Диоксид кремния — кислотный оксид. Ему соответствуют слабые кремниевые кислоты, объединяемые общей формулой /zSi02 mH20. В свободном состоянии выделены ортокремниевая H^SiO^, метакремниевая (или кремниевая) H2Si03 и несколько других кислот.
При подкислении водного раствора силиката натрия выделяется свободная кремниевая кислота:
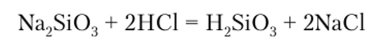
Метакремниевая кислота H2Si03 в свежеохлажденном виде представляет собой студенистое вещество, отвечающее формуле (H2Si03)v.
Кислота Il2Si03 термически неустойчива и при нагревании легко разлагается на Si09 и воду:
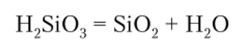
Кремниевая кислота слабее угольной, которая вытесняет H2Si03 из водных растворов ее солей:
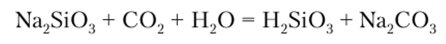
Растворимые в воде соли кремниевой кислоты имеют в водных растворах щелочную реакцию, что обусловлено их гидролитическим расщеплением, в результате которого образуются соли поликремниевых кислот:
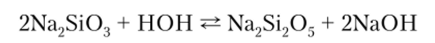
Кремниевую кислоту нельзя получить в чистом виде. При осаждении в водных растворах она образует коллоидный раствор, или золь, который существует очень малый промежуток времени. Золь далее коагулирует, и образуется гель. При высушивании геля образуются продукты с пористой структурой — силикагели, применяемые в качестве осушителей и адсорбентов.
Соли кремниевой кислоты — силикаты, за исключением силикатов натрия и калия, нерастворимы в воде. Для качественного обнаружения растворимых силикатов применяется следующая реакция:
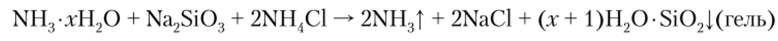
Происходит образование характерного осадка (гель кремниевой кислоты).
Водные растворы Na2Si03 и K2Si03 называют жидким стеклом и применяют для изготовления кислотоупорного цемента и бетона. При нагревании смесей многих силикатов с диоксидом кремния получаются аморфные сплавы — стекла.
Поликремниевые кислоты обычно рассматриваются как производные от ортои метакремниевых кислот или от обеих кислот одновременно (рис. 23.6).
Производные от метакремниевой кислоты соответственно называют ди-, три-, тетраи т.д. метакремниевыми кислотами.
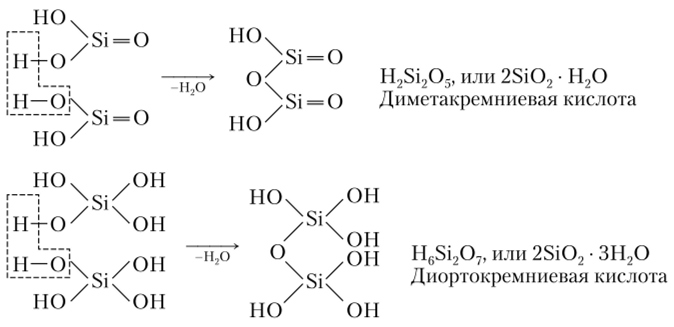
Рис. 23.6. Примеры образования иоликремниевых кислот
Кислоты, образованные от ортокремниевой кислоты, также называют ди-, три-, тетраи т.д. ортокремниевыми кислотами.
Силикаты широко распространены в природе. Состав природных силикатов в основном выражается сложными формулами, поэтому их обычно изображают в виде всех оксидов, образующих силикат: каолин Al20;j-2Si02-2H20, белая слюда K., 0−3Al20;j-6Si02-2H20, асбест Ca0−3Mg0−4Si02.
Из алюмосиликатов большое значение имеют цеолиты, состав которых выражается общей формулой МегЭ 02 • Н20, где Me — Са, Na (реже Ва, Sr, К), Э — Si и А1 в переменном соотношении.
Цеолиты способны обменивать воду на другие вещества (NH3, спирт и т. д.), поэтому они используются в качестве так называемых молекулярных сит. Молекулярные сита поглощают вещества, молекулы которых могут войти в их полости, что находит широкое применение для разделения газообразных веществ, осушки газов и жидкостей. В цеолитах одни катионы могут замещаться другими, поэтому их используют в качестве ионообменников — катионитов.
Кроме неорганических соединений значительный интерес представляют кремнийорганические соединения. В настоящее время к кремнийорганическим соединениям относят лишь те, для которых характерна связь Si—С: тетраметилсилиций Si (CH3)4, тетраэтилсилиций Si (C2H5)4.
Кроме таких соединений, известны и кремнийорганические соединения, которые могут быть представлены в виде сложных эфиров:
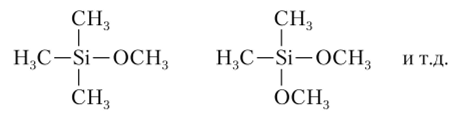
При гидролизе этих соединений получаются гидроксильные производные, которые далее могут конденсироваться с образованием полимерных соединений: 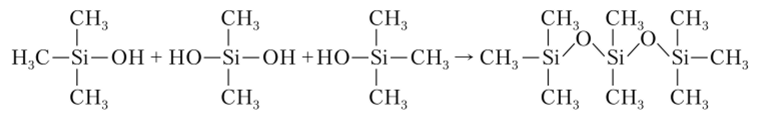
Высокомолекулярные соединения, содержащие группировки.
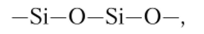
называют силиконами. В зависимости от отношения числа органических радикалов R к числу атомов кремния (R/Si) получают продукты с широким интервалом свойств. Так, при R/Si > 2 получаются вязкие жидкости (силиконовые масла), при R/Si «2 — эластичные каучукоподобные массы, а при R/Si < 2 — твердые вещества с различной степенью жесткости.