Свойства бромоводорода.
Бромоводород.
Лабораторное получение бромоводорода

Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5% молекул: Водный раствор бромистого водорода образует сильную одноосновную кислоту: Как кислота реагирует с металлами, их оксидами, основаниями: Таблица 2. Свойства и особенности строения бромоводорода. Восстанавливает концентрированную серную кислоту: Электронная конфигурация в основном состоянии. Рис. 1. Строение… Читать ещё >
Свойства бромоводорода. Бромоводород. Лабораторное получение бромоводорода (реферат, курсовая, диплом, контрольная)
Особенности строения и физические свойства
В таблице 1. и таблице 2. представлены особенности строения атома брома и бромоводорода соответственно.
Таблица 1. Особенности строения брома.
Свойство. | Br. | |
Заряд ядра Z. | ||
Электронная конфигурация в основном состоянии. | [Ar]3dl04s24p5 | |
Энергия ионизации, кДж/моль. | ||
Энергия сродства к электрону, кДж/моль. | ||
Электроотрицательность: по Полингу. по Оллреду-Рохову. |
| |
Атомный радиус, нм. | 0,085. | |
Устойчивые степени окисления. | — 1,0, +1,. +3, (+4), +5, +7. | |
Таблица 2. Свойства и особенности строения бромоводорода.
Свойство. | НВг. | |
Длина связи Н-X, нм. | 0,141. | |
Энергия связи, кДж/моль. | ||
Энтальпия образования, кДж/моль. | — 36. | |
Дипольный момент, D. | 0,79. | |
рКа=-lgКа | — 11,2. | |
tпл, °C. | — 87. | |
tкип, °C. | — 67. | |
В бромоводороде осуществима ковалентная связь за счет неспаренного электрона водорода и неспаренного электрона в броме.
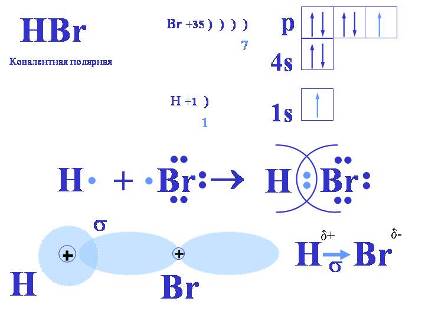
Рис. 1. Строение молекулы бромоводорода.
В данном случае форма молекулы асимметрична, то есть молекула полярна. Полярность несимметричной по форме молекулы вытекает из полярности ковалентных связей между атомами элементов с разной электроотрицательностью.
Бромистый водород и его водный раствор — бромистая кислота, относятся к числу наиболее важных бромирующих средств. Оба они являются весьма реакционноспособными веществами и могут быть использованы как сырье для получения большого количества полезных соединений брома, как органических, так и неорганических.
Бромистый водород представляет собой бесцветный газ с резким запахом и кислым вкусом, конденсирующая в жидкость с температурой кипения -67оС и температурой затвердевания -84 оС. При сильном нагревании бромистый водород подвергается термической диссоиации на 1,1% при 1200 оС, проявляя большую устойчивость, чем HI, но меньшую, чем HCl. Растворимость HBr в воде очень велика: 600 объемов в 1 объем воды при 0 оС, при низких температурах образуется несколько кристаллогидратов: HBr*4H2O с t пл. = -56 оС, HBr*3H2O с t пл. = -48 оС, HBr*2H2O с t пл. = -11,3оС и HBr*H2O, который под давлением 1 атм разлагается при температуре -28,5 оС. Водный раствор бромистого водорода носит название бромистоводородной кислоты.
С водой бромистый водород образует азеотропную смесь; она содержит 47,6% НВr и кипит при 124,3° (760 мм рпг. ст.).
Бромистоводородная кислота может быть получена в любых концентрациях, примерно до 70%-ой, но промышленностью она поставляется обычно с содержанием в растворе 34, 40, 48 или 62% бромистого водорода. Например ее водный азеотроп при 760 мм рпг. ст. кипит при 124,3°С и содержит 47,6% НВr. По силе восстановительных свойств эта кислота занимает промежуточное положение между йодоводородной и соляной. Чистая кислота не проводит электрический ток, и в отсутствии воды при обычной температуре очень мало реакционноспособна. В твердом состоянии образует молекулярную решетку. Кристаллизуется выше 98оС, соответственно 111оК — в кубической гранецентрированной решетке, при более низкой температуре — в ромбической решетке, с выше 119оК HBr существует в три модификации с достаточно сложной решеткой. В водных растворах почти нацело диссоциирована и хорошо проводит электрический ток. Бромистоводородная кислота (реактив), выпускаемая промышленностью, должна отвечать требованиям ГОСТ 2062; 43. Продукт марки «чистый для анализа» и «чистый» должен содержать не менее 40% НВr и примесей не более, чем 0,6%.
Химические свойства
1. Водный раствор бромистого водорода образует сильную одноосновную кислоту:
HBr + H2O — Br- + H3O+ pK = -9.
- 2. Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5% молекул:
- 2HBr — H2 + Br2
- 3. Как кислота реагирует с металлами, их оксидами, основаниями:
- 2HBr + Mg > MgBr2 + H2^
- 2HBr + CaO > CaBr2 + H2O
HBr + NaOH > NaBr + H2O.
- 4. Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы, со временем, окрашиваются в бурый цвет:
- 4HBr + O2 > 2Br2 + 2H2O
- 5. Восстанавливает концентрированную серную кислоту:
HBr + H2SO4 > Br2 + SO2 +2H2O.