Термическое разложение углеводородов

Энергия разрыва С-Н-связи наибольшая в метане (431,2 кДж/моль), снижается с удлинением цепи углеводорода СnН2n+2• Однако при п > 5 значение энергия разрыва связи С-Н в СН3-группе становится постоянным. При числе углеродных атомов в молекуле парафинового углеводорода нормального строения равном или более пяти па отрыв атома водорода от СН3-группы требуется 391,9 кДж/моль. Энергия отрыва… Читать ещё >
Термическое разложение углеводородов (реферат, курсовая, диплом, контрольная)
Термодинамика разложения
Энергия разрыва связей
На начальных стадиях термического разложения обычно рвутся химические связи с наименьшей энергией разрыва. В табл. 1.9 приведены значения энергий разрыва связей D в молекулах некоторых углеводородов, в кДж/моль[1].
Таблица 1.9
Значения энергий разрыва связей
Молекула. | D | Молекула. | D |
СН3-Н. | 431,2. | н-С3Н7-н-С3Н7. | 318,2. |
C2H6-H. | 410,3. | изо-С3Н7-изо-С3Н7. | 320.3. |
н-С3Н7-Н. | 397,7. | н-С4Н9-СН3. | 334,9. |
изо-С3Н7-Н. | 393,6. | н-С4Н9-С3Н7. | 314,0. |
н-C4H9-H. | 393,6. | Н-С4Н9-изо-С3Н7. | 316,5. |
изо-С4Н9-Н. | 389,4. | СН3СН2СН (СН3)-н-С3Н7. | 314,0. |
CH3-CH3. | 360,0. | СН3С (СН3)2-СН (СН3)СН3. | 295,6. |
с2н5-сн3. | 337,0. | Н-С4Н9-Н-С4Н9. | 309,8. |
C2H3-C2HS. | 332,8. | ||
Энергия разрыва С-Н-связи наибольшая в метане (431,2 кДж/моль), снижается с удлинением цепи углеводорода СnН2n+2• Однако при п > 5 значение энергия разрыва связи С-Н в СН3-группе становится постоянным. При числе углеродных атомов в молекуле парафинового углеводорода нормального строения равном или более пяти па отрыв атома водорода от СН3-группы требуется 391,9 кДж/моль. Энергия отрыва водородного атома от СН2-группы в молекулах парафинов практически не изменяется, начиная с пятого атома углерода и до конца цепи. Энергии отрыва атома водорода, но В. В. Воеводскому, в углеводороде С12Н62 (С (1)-С (2)-) приведены в табл. 1.10.
Таблица 1.10
Значения энергии отрыва атома водорода
Атом С. | C1,12. | C2,11. | С3,10. | C4,9. | С5,8. | С6,7. |
D, кДж/моль. | 391,9. | 371,8. | 363,8. | 360,5. | 359,2. | 358,8. |
Энергия разрыва связи С-Н для вторичного атома углерода в молекулах пропана и бутана примерно на 4,18 кДж/моль меньше, чем для первичного. Энергия отрыва атома водорода от третичного углеродного атома в случае бутана примерно на 16,75 кДж/моль меньше, чем от вторичного.
Энергия разрыва С-С-связи в парафиновых углеводородах уменьшается в следующем порядке:
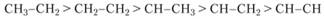
В табл. 1.11 приведены значения энергии? кДж/моль разрыва одинарных связей в молекулах олефинов и диенов.
Энергия разрыва связи С-Н у атома углерода при двойной связи больше, чем в парафиновых углеводородах. Для атома углерода, находящегося в ?-положении к двойной связи, энергия разрыва связи С-Н значительно ниже, чем для парафиновые углеводородов. Энергия разрыва связи С-С, находящейся в ?-положении к двойной, больше, a в ?-положении — значительно меньше, чем энергия разрыва обычной связи С-С. В молекуле диаллила связь С-С, сопряженная с двойными, еще более ослаблена, энергия разрыва ее составляет всего 175,8 кДж/моль. Смещение электронной плотности в сторону ненасыщенного атом углерода (эффект сопряжения) сильно влияет на энергию разрыва связей в молекулах непредельных углеводородов, упрочивая связи, находящиеся в ?-положении к двойной, и ослабляя связи в ?-положении.
Энергия разрыва двойной связи 502,4 кДж/моль значительно меньше, чем удвоенная энергия разрыва связи С-Н (360,1 кДж/моль) в этане. Кроме разрыва двойной связи с образованием двух бирадикалов возможен разрыв ?-связи:
Таблица 1.11
Значения энергии разрыва одинарных связей
Молекула. | D | Молекула. | D |
СН2=СН-Н. | 435,4. | СН2=СНСН2-СН3. | 259,6. |
СН2-СНСН2-H. | 322,4. | СН2=СНСН2-СН=СН2. | 309.8. |
СН-С (СН3)СН2-Н. | 322,4. | СН3=СН-СН=СН2. | 435,4. |
СН3СН=СНСН2-H. | 334,9. | СН2-СНСН2-СН2СН-СН2. | 175,8. |
СН2=СН2. | 502,4. | СН2=С (СН3)СН2-СН3. | 268,0. |
СН2-СН-СН3. | 393,6. | СН3СН=СНСН2-СН3. | 276,3. |

Можно полагать[2], что энергия раскрытия двойной связи с образованием бирадикала в молекулах олефинов одинакова и составляет около 239 кДж/моль. Энергия разрывая-связи, сопряженной с двойной, оказывается значительно (па 63−67 кДж/моль) ниже, чем несопряженной ?-связи.
На рис. 1.20 представлены значения энергий разрыва связей (в кДж/моль) в молекулах ароматических углеводородов.
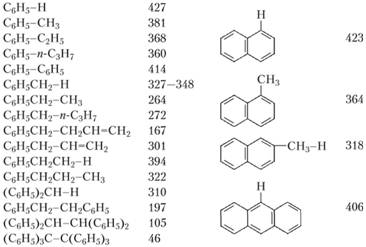
Рис. 1.20. Значения анергий разрыва связей (в кДж/моль) в молекулах ароматических углеводородов.
В алкилароматических углеводородах слабейшей является связь С-С, сопряженная с бензольным кольцом. При этом влияние бензольного кольца количественно близко к влиянию двойной связи в олефинах. Так, энергия разрыва связей С6Н3СН2-СН3 и СН2СНСН2-СН3 соответственно составляет 264 и 257 кДж/моль, а энергия разрыва связей С6Н5СН2-Н и СН2СНСН2-Н — соответственно 327 и 322 кДж/моль. Сопряжение с большим числом бензольных колец снижает прочность связи еще больше. Так, в 1,2-дифенилэтане энергия разрыва связи составляет 197 кДж/моль, в 1,1,2,2-тетрафенилэтане — 105 кДж/моль, в гексафенилэтане — всего 46 кДж/моль.
Связь С-Н в бензольном кольце прочнее, чем в молекулах парафиновых углеводородов, исключая простейший углеводород метан. Экспериментально разрыв связи С-С в ароматическом кольце наблюдается при крекинге в электрической дуге (распад до ацетилена) и, возможно, при крекинге до углерода. В последнем случае всегда в небольших количествах образуется метан, что может происходить только в результате разрыва бензольного кольца.
- [1] Page F. М., Sugden Т. М. Effect of halogens on the ionization in alkali-laden hydrogen and acetylene flames // Trans. Farad. Soc. 1957. Vol. 53. P. 1092−1110.
- [2] Page F. М., Sugden Т. М. Observations on the kinetics of the ionization of alkali metals in flame gases Trans. Faraday Soc. 1958. Vol. 54. P. 372−380.