Статистическая термодинамика.
Физическая и коллоидная химия

Большой канонический ансамбль описывает открытые системы, находящиеся в тепловом равновесии и способные обмениваться веществом с окружающей средой. Тепловое равновесие характеризуется температурой Т, а равновесие по числу частиц — химическим потенциалом р. Поэтому функция распределения зависит от температуры и химического потенциала. Явное выражение для функции распределения большого… Читать ещё >
Статистическая термодинамика. Физическая и коллоидная химия (реферат, курсовая, диплом, контрольная)
В результате изучения материала главы 9 студент должен: знать основные постулаты статистической термодинамики; уметь рассчитывать суммы по состояниям и знать их свойства; пользоваться терминами и определениями, приведенными в главе;
владеть специальной терминологией; навыками расчета термодинамических функций идеальных газов статистическими методами.
Основные постулаты статистической термодинамики
Термодинамический метод не применим к системам, состоящих из малого числа молекул, так как в таких системах исчезает различие между теплотой и работой. Одновременно исчезает однозначность направления процесса:
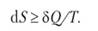
Для очень малого числа молекул оба направления процесса становятся равноценными. Для изолированной системы — приращение энтропии или равно приведенной теплоте (для равновесно-обратимых процессов), или больше ее (для неравновесных). Такая дуалистичность энтропии может быть объяснена с точки зрения упорядоченности — неупорядоченности движения или состояния составляющих систему частиц; следовательно, качественно энтропию можно рассматривать как меру неупорядоченности молекулярного состояния системы. Эти качественные представления количественно развиваются статистической термодинамикой. Статистическая термодинамика является частью более общего раздела науки — статистической механики.
Основные принципы статистической механики были развиты в конце XIX в. в трудах Л. Больцмана и Дж. Гиббса.
При описании систем, состоящих из большого числа частиц, можно использовать два подхода: микроскопический и макроскопический. Макроскопический подход используется классической термодинамикой, где состояния систем, содержащих единственное чистое вещество, определяется в общем случае тремя независимыми переменными: Т (температура), V (объем), N (число частиц). Однако, с микроскопической точки зрения, система, содержащая 1 моль вещества, включает 6,02 • 1023 молекул. Кроме того, в первом подходе подробно характеризуется микросостояние системы, например координаты и импульсы каждой частицы в каждый момент времени. Микроскопическое описание требует решения классических или квантовых уравнений движения для огромного числа переменных. Так, каждое микросостояние идеального газа в классической механике описывается 6N переменными (N — число частиц): ЗN координат и ЗN проекций импульса.
Если система находится в равновесном состоянии, то ее макроскопические параметры постоянны, тогда как микроскопические параметры изменяются со временем. Это означает, что каждому макросостоянию соответствует несколько (на самом деле — бесконечно много) микросостояний (рис. 9.1).

Рис. 9.1. Установление соответствия между макрои микросостояниями.
Статистическая термодинамика устанавливает связь между этими двумя подходами. Основная идея заключается в следующем: если каждому макросостоянию соответствует много микросостояиий, то каждое из них вносит в макросостояние свой вклад. Тогда свойства макросостояния можно рассчитать как среднее, но всем микросостояниям, т. е. суммируя их вклады с учетом статистического веса.
Усреднение по микросостояниям проводят с использованием понятия статистического ансамбля. Ансамбль — это бесконечный набор идентичных систем, находящихся во всех возможных микросостояниях, соответствующих одному макросостоянию. Каждая система ансамбля — это одно микросостояние. Весь ансамбль описывается некоторой функцией распределения по координатам и импульсам р (р, q, t), которая определяется следующим образом: р (p, q, t)dpdq — это вероятность того, что система ансамбля находится в элементе объема dpdq вблизи точки (р, q) в момент времени t.
Смысл функции распределения состоит в том, что она определяет статистический вес каждого микросостояния в макросостояпии.
Из определения следуют элементарные свойства функции распределения:
- 1) нормировка
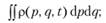 (9.1)
(9.1)- 2) положительная определенность
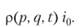 (9.2)
(9.2)
Многие макроскопические свойства системы можно определить как среднее значение функций координат и импульсов f (p, q) по ансамблю:
 (9.3).
(9.3).
Например, внутренняя энергия — это среднее значение функции Гамильтона Н (р, q):
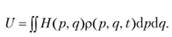 (9.4).
(9.4).
Существование функции распределения составляет суть основного постулата классической статистической механики: макроскопическое состояние системы полностью задается некоторой функцией распределения, которая удовлетворяет условиям (9.1) и (9.2).
Для равновесных систем и равновесных ансамблей функция распределения не зависит явно от времени: р = р (p, q). Явный вид функции распределения зависит от типа ансамбля. Различают три основных тина ансамблей:
- 1) микроканонический ансамбль описывает изолированные системы и характеризуется переменными: E (энергия), V (объем), N (число частиц). В изолированной системе все микросостояния равновероятны (постулат равной априорной вероятности):
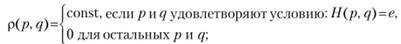 (9.5)
(9.5)
- 2) канонический ансамбль описывает системы, находящиеся в тепловом равновесии с окружающей средой. Тепловое равновесие характеризуется температурой Т. Поэтому функция распределения также зависит от температуры:
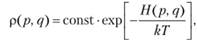
(9.6).
где k = 1,38 • 10-23 Дж/К — постоянная Больцмана. Значение константы в выражении (9.6) определяется условием нормировки.
Частным случаем канонического распределения (9.6) является распределение Максвелла по скоростям ь которое справедливо для газов:
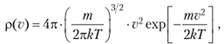 (9.7).
(9.7).
где m — масса молекулы газа. Выражение р (v)dv описывает вероятность того, что молекула имеет абсолютное значение скорости в интервале от v до v + d&. Максимум функции (9.7) дает наиболее вероятную скорость молекул, а интеграл.
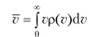 (9.8).
(9.8).
среднюю скорость молекул.
Если система имеет дискретные уровни энергии и описывается квантовомеханически, то вместо функции Гамильтона Н (р, q) используют оператор Гамильтона Н, а вместо функции распределения — оператор матрицы плотности р:
 (9.9).
(9.9).
Диагональные элементы матрицы плотности дают вероятность того, что система находится в і-м энергетическом состоянии и имеет энергию Е{.
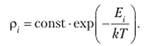 (9.10).
(9.10).
Значение константы определяется условием нормировки: 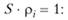
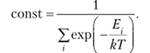 (9.11).
(9.11).
Знаменатель этого выражения называют суммой по состояниям. Он имеет ключевое значение для статистической оценки термодинамических свойств системы. Из выражений (9.10) и (9.11) можно найти число частиц Njf имеющих энергию.
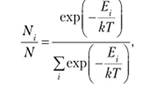 (9.12).
(9.12).
где N — общее число частиц. Распределение частиц (9.12) по уровням энергии называют распределением Больцмана, а числитель этого распределения — больцмановским фактором (множителем). Иногда это распределение записывают в другом виде: если существует несколько уровней с одинаковой энергией ?, то их объединяют в одну группу путем суммирования больцмановских множителей:
 (9.13).
(9.13).
где gj — число уровней с энергией Ej, или статистический вес.
Многие макроскопические параметры термодинамической системы можно вычислить с помощью распределения Больцмана. Например, средняя энергия определяется как среднее по уровням энергии с учетом их статистических весов:
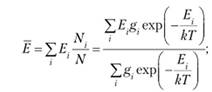 (9.14).
(9.14).
3) большой канонический ансамбль описывает открытые системы, находящиеся в тепловом равновесии и способные обмениваться веществом с окружающей средой. Тепловое равновесие характеризуется температурой Т, а равновесие по числу частиц — химическим потенциалом р. Поэтому функция распределения зависит от температуры и химического потенциала. Явное выражение для функции распределения большого канонического ансамбля мы здесь использовать не будем.
В статистической теории доказывается, что для систем с большим числом частиц (~1023) все три типа ансамблей эквивалентны друг другу. Использование любого ансамбля приводит к одним и тем же термодинамическим свойствам, поэтому выбор того или иного ансамбля описания термодинамической системы диктуется только удобством математической обработки функций распределения.