Элементы подгруппы мышьяка

В группе УА выделяют подгруппу мышьяка, в которую входят также сурьма и висмут. Все эти элементы в виде металлов или соединений известны с древних времен. Значительные добавки мышьяка и сурьмы обнаружены в старинных медных сплавах. Черный порошок сульфида сурьмы применялся в косметических составах. Отсюда происходит глагол «сурьмиться» — применять косметику. Мышьяк приобрел известность как… Читать ещё >
Элементы подгруппы мышьяка (реферат, курсовая, диплом, контрольная)
В группе УА выделяют подгруппу мышьяка, в которую входят также сурьма и висмут. Все эти элементы в виде металлов или соединений известны с древних времен. Значительные добавки мышьяка и сурьмы обнаружены в старинных медных сплавах. Черный порошок сульфида сурьмы применялся в косметических составах. Отсюда происходит глагол «сурьмиться» — применять косметику. Мышьяк приобрел известность как элемент ядовитых препаратов, в частности белого мышьяка (А8203), применяемого в стоматологии. Висмут издавна применяли в сплавах, считая его разновидностью свинца. По распространенности в природе мышьяк и сурьма приблизительно в 100 раз превосходят соответствующие элементы подгруппы селена. Внутри подгруппы распространенность каждого следующего элемента (Аз — ЭЬ — В1) уменьшается на порядок. Следствием относительно высокой распространенности мышьяка, сурьмы и висмута является образование ими собственных минералов, чем и обусловлено практическое применение их с древности. Для этих элементов характерно образование связей с серой. В природе встречается желто-золотистый аурипигмент Аз283, блестящий черный антимонит, или сурьмяный блеск, 8Ь253, висмутин В1233. В небольшом количестве находят в природе и самородные мышьяк, сурьму и висмут. Сернистые минералы этих элементов путем обжига превращаются в оксиды, а оксиды восстанавливаются углем:
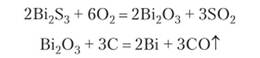
Электронное строение атомов в подгруппе мышьяка аналогично азоту и фосфору, но с учетом уже отмечавшегося различия: эти элементы имеют 18-электронную подоболочку. Это видно на примере диаграммы атома мышьяка:
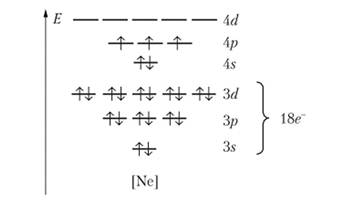
Атомы с таким строением характеризуются повышенной поляризуемостью. В результате этого, в частности, значительно усиливается склонность к образованию химических связей с серой. Хорошо известная ядовитость соединений мышьяка связана с его способностью присоединяться к атомам серы в белках.
В подгруппе мышьяка наблюдается последовательное усиление металлических свойств. В то время как фосфор практически не проявляет металличности, мышьяк образует простое вещество с металлическим блеском и высокой электропроводностью. Эта форма мышьяка называется серым мышьяком. При обычном давлении мышьяк не плавится, так как при 633 °C давление пара достигает 101 кПа (1 атм) и серый мышьяк испаряется. Плавление происходит под давлением 36 атм при 817 °C. При быстром охлаждении паров мышьяка образуется желтый мышьяк, состоящий из молекул А84 и аналогичный белому фосфору. Желтый мышьяк неустойчив и постепенно превращается в серый.
Сурьма в устойчивом состоянии представляет собой металл (?пл = = 631°С), но известна и желтая сурьма, еще менее устойчивая, чем желтый мышьяк. Висмут известен только в металлической форме (Гпл = 271°С). Это серый металл со слабым красноватым оттенком.
В ряду элементов от фосфора до висмута наблюдается понижение устойчивости водородных соединений ЭН3. Очень ядовитый газ арсин АзН3,.
имеющий чесночный запах, образуется при восстановлении кислородных соединений мышьяка металлами в кислой среде (реакция Марша):

Если выделяющийся арсин пропускают через нагретую стеклянную трубку, то вещество разлагается и на стекле оседает мышьяк. Прибор для проведения испытания пробы на примесь мышьяка показан на рис. 20.8.
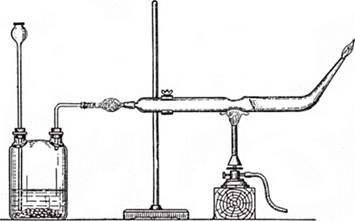
Рис. 20.8. Прибор для обнаружения мышьяка.
В колбу помещают цинк (без примеси мышьяка!) и соляную кислоту. После заполнения прибора выделяющимся водородом в колбу через воронку вносят исследуемый образец, а стеклянную трубку нагревают в месте сужения газовой горелкой. Если в пробе есть мышьяк, то образующийся арсин разлагается в горячей зоне трубки и на стекле появляется зеркальный налет мышьяка. Реакцию применяют для обнаружения примеси мышьяка в различных материалах. Сурьма тоже дает похожую реакцию, по возникающее на стекле «сурьмяное зеркало», в отличие от мышьякового, растворяется при заполнении трубки раствором гипохлорита натрия.
С металлами мышьяк образует арсениды, аналогичные фосфидам. Особого внимания заслуживает арсенид галлия ваАя. Это соединение, образованное двумя элементами — соседями германия справа и слева. На каждый атом в среднем приходится четыре электрона, как у германия. Они образуют между собой по четыре ковалентные связи, и возникает кристаллическая структура, подобная структуре германия, со строгим чередованием атомов ва и Ля. Арсенид галлия оказывается полупроводником (как и германий), в то время как исходные вещества являются металлическими проводниками. В качестве полупроводника арсенид галлия нашел очень широкое применение.
Мышьяк образует два оксида — оксид мышьяка (Ш) Ая203 (белый мышьяк) и оксид мышьяка (У) Ля205.
Оксид мышьяка (Ш), называемый белым мышьяком, представляет собой амфотерное вещество с очень слабыми кислотными и основными свойствами. Растворимость при 20 °C — 3,7 г в 100 г воды. В растворе мышьяк присутствует в гидратированной форме ортомышьяковистой кислоты НзАбОз и частично метамышьяковистой кислоты НАз02. При переходе в осадок происходит полная дегидратация до Аз203. Осадок Аз203 растворяется как в растворе гидроксида натрия, так и в соляной кислоте:
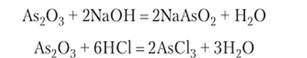
Метаарсенит натрия ЫаАз02 образуется с примесью ортоарсенита Ыа3А803.
Белый мышьяк применяется в качестве ядовитого вещества в стоматологии для некротизации зубной пульпы. В малых дозах соединения мышьяка проявляют антианемическое и общеукрепляющее действие.
Мышьяковистая кислота окисляется окислителями более сильными, чем йод, до мышьяковой кислоты Н3Аз04. Это трехосновная, устойчивая кислота, по силе очень близкая к фосфорной кислоте. Многие соли мышьяковой и фосфорной кислот имеют одинаковые кристаллические структуры, т.с. изоморфны. При изучении этих солей и было открыто явление изоморфизма. Возникновение изоморфных кристаллов возможно при различии радиусов неодинаковых атомов в веществах не более чем на 15%. В данном случае различие радиусов фосфора (110 им) и мышьяка (121 им) составляет 10%. Арсенаты, похожие по свойствам на фосфаты, не проявляют сильных ядовитых свойств, но из-за способности восстанавливаться до А8(П1) арсенаты оказываются не менее опасны, чем арсениты.
Мышьяковые кислоты реагируют в растворах с хлороводородом, образуя хлориды мышьяка:
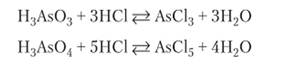
На основании этих реакций можно сделать вывод, что ионы С1″ и ОН- конкурируют между собой за образование связей с катионами мышьяка. Таким образом, мышьяк ведет себя как мягкая кислота.
Из растворов мышьяковых кислот в сильно кислой среде (в присутствии НС1) сероводородом осаждаются желтые сульфиды мышьяка Аб^з и Аб^з. Сурьма в аналогичных условиях образует красный осадок БЬ^.
От фосфора к висмуту наблюдается также последовательное уменьшение устойчивости пятивалентного состояния в соединениях с кислородом и галогенами. Фосфорная кислота и фосфаты в растворах практически не восстанавливаются. Мышьяковая кислота Н3Аз04 и соответствующие ей соли арсенаты ведут себя как окислители средней силы, близкие по силе к йоду. Поэтому реакция.
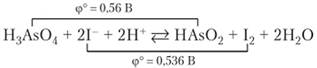
обратима, имея константу равновесия К = 6,5.
У соединений сурьмы (У) окислительные свойства еще более усиливаются. У висмута пятивалентное состояние становится малоустойчивым. Оксид В1205 в чистом виде получить не удается. Более устойчив висмутат натрия ИаВЮ3, получающийся при обработке хлором взвеси В1203 в концентрированной щелочи:
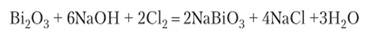
Это желтое, нерастворимое в воде вещество с очень сильными окислительными свойствами. Например, соли марганца (Н) окисляются висмутатом натрия в перманганат-ион:
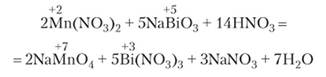
В соединениях сурьмы, по сравнению с мышьяком, более четко проявляется ее металлический характер, в частности сурьма (Ш) образует соли с анионами кислородных кислот, что совершенно нехарактерно для неметаллов. Хлорид сурьмы (Ш) по свойствам приближается к обычным солям. Сурьма (V) проявляет более сильно выраженные кислотные свойства. Одна из форм сурьмяной кислоты может быть представлена как комплексное соединение П|5Ь (ОМ)6]. Натриевая соль этой кислоты Ыа[5Ь (ОН)6] малорастворима в воде, что является редким случаем для солей натрия.
Висмут в трехвалентном состоянии проявляет только основные свойства. Он образует соли с анионами многих кислот. Сульфид висмута В1283 — нерастворимое в воде вещество черного цвета. Нитрат висмута в результате гидролиза легко дает белый осадок основного нитрата ВЮЫО•*:
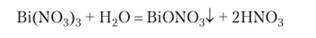
Это вещество применяется при желудочных заболеваниях в качестве вяжущего и обволакивающего средства. Аналогичным действием обладают и некоторые основные соли висмута с анионами органических кислот.
Главная область применения висмута — это приготовление специальных сплавов, в том числе легкоплавких. Например, сплав Вуда, содержащий 50% висмута, 25% свинца и, но 12,5% кадмия и олова, плавится при 69 °C.