Практическое значение растворов

Кислоту приливают к тетраборату натрия постепенно, сначала по 2—3 капли, а в конце по одной капле. Этот процесс называется титрованием. Для наблюдения за ходом реакции в раствор тетрабората натрия вносят каплю индикатора. Если взят индикатор метиловый оранжевый, то раствор в колбочке становится желтым. Как только добавлено количество кислоты, достаточное для завершения реакции с имеющимся… Читать ещё >
Практическое значение растворов (реферат, курсовая, диплом, контрольная)
Применение растворов необозримо широко в быту, химической промышленности и лабораториях, пищевой промышленности, медицине, производстве и применении лекарств и т. д. Рассмотрим основные причины, делающие растворы столь необходимыми в практической деятельности.
1. В жидких растворах химические реакции протекают в объеме, и поэтому все имеющееся вещество доступно для химического превращения без дополнительного воздействия на систему. Частицы веществ в растворах хаотически движутся и сталкиваются, что является необходимым условием их химического превращения. Для сравнения представим себе, как идет химическая реакция в смеси твердых веществ. Их частицы закреплены в кристаллической структуре. Кристаллы соприкасаются в отдельных точках, в которых только и возможно взаимодействие частиц. Частицы, находящиеся в объеме кристалла (не на поверхности), участвовать в реакции не могут. Для ускорения реакции кристаллы перетирают в ступке, прессуют, но и при этом полнота протекания реакции достигается далеко не сразу. Некоторые лекарства выпускают в виде больших таблеток, представляющих собой спрессованную смесь веществ. Обезболивающие таблетки эффералган кроме активного вещества парацетамола содержат лимонную кислоту, соду и другие добавки. При внесении таблетки в воду начинается выделение газа в результате реакции лимонной кислоты с содой:
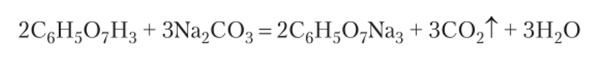
Очевидно, что твердые вещества в таблетке не реагировали между собой, но, растворяясь, начали реагировать.
Бывает и так, что твердые вещества реагируют в форме взрыва. Выделение энергии, начавшееся в результате превращения отдельных частиц, расшатывает структуру вещества, и реакция лавинообразно ускоряется. Такие опасные явления редко происходят в растворах, особенно в водных. Выделяющаяся энергия аккумулируется большой массой растворителя, и сильного разогревания системы не происходит.
Итак, растворы чрезвычайно важны как среда для проведения химических реакций. Можно также сказать, что растворы по своей природе подвижны. Именно такие системы пригодны в качестве внутренней среды живых организмов, так как жизнедеятельность основана на постоянном протекании множества химических превращений.
2. Растворы имеют собственные физические свойства, отличные от свойств индивидуальных веществ. К таким свойствам относятся плотность, электрическая проводимость, давление пара над раствором, температуры замерзания и кипения и др. Вода и хлорид натрия в отдельности электричество практически не проводят, но раствор хлорида натрия имеет высокую электрическую проводимость.
Можно готовить растворы заданной плотности, подбирая растворитель, вещество для растворения и его концентрацию. Такие растворы пригодны для разделения механических смесей: одни частицы смеси при выбранной плотности оседают, а другие всплывают. Таким способом различают алмазы и ограненное стекло.
На практике находит применение явление понижения температуры замерзания раствора по сравнению с чистым растворителем. Вода замерзает при 0 °C, увеличивая свой объем. На морозе она может разрывать стеклянные сосуды, металлические трубы и т. д. Воду при температуре ниже 0 °C нельзя применять для охлаждения двигателей, в том числе автомобильных. Вместо воды применяют антифриз — водный раствор этиленгликоля НОСН2СН2ОН, замерзающий при -40°С, а при повышенном содержании этиленгликоля даже при -65°С. Применение химических реагентов для таяния льда и снега на дорогах также основано на понижении температуры замерзания растворов.
Металлические сплавы, которые могут быть твердыми растворами, дают много примеров изменения свойств твердых растворов по сравнению с индивидуальными металлами.
3. Применяя вещество в растворе, можно изменять силу его действия или активность. Это хорошо видно на примере ярко окрашенного раствора перманганата калия КМп04, действующего как окислитель. Раствор с интенсивной фиолетовой окраской, содержащий 2−5% КМп04, применяют для смазывания язвенных и ожоговых поверхностей. Раствор, разбавленный до ярко-розовой окраски (0,1−0,5%), применяется для промывания ран. Еще более разбавленный бледно-розовый раствор, содержащий 0,01−0,1% КМп04, пригоден для полоскания рта и горла, промывания желудка.
Очевидно, что окраска, а также сила воздействия вещества зависят от концентрации приготовленного раствора. Точно так же и в других случаях применение вещества в растворе позволяет контролировать его действие с целью получения наибольшего полезного эффекта и снижения токсического или разрушающего результата. Это делает растворы особенно ценными для использования как в прикладных областях, так и в самой химии.
4. Растворение веществ широко применяется для их очистки и разделения. На рис. 12.1 на примере дихромата калия К2Сг207 показан принцип метода очистки, называемого перекристаллизацией. Порцию вещества растворяют при нагревании, и раствор фильтруют. При фильтровании отделя.
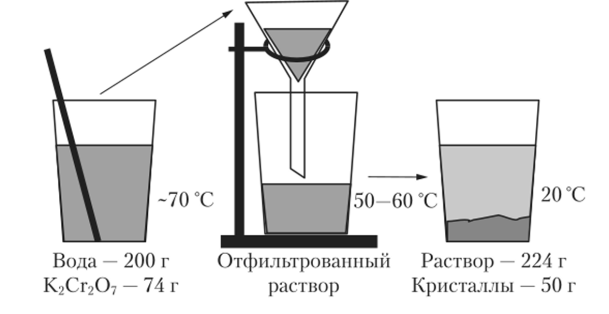
Рис. 12.1. Очистка вещества перекристаллизацией
ются нерастворимые примеси. Затем отфильтрованный раствор охлаждают, и при этом кристаллизуется очищенное вещество. Значительная доля растворимых примесей остается в растворе. Кристаллы вещества отфильтровывают и сушат.
Для извлечения и разделения биологически активных веществ из высушенных растений применяют широкий набор органических растворителей.
5. Растворы с известной концентрацией можно быстро отмеривать определенными порциями и по объему порции рассчитывать количество содержащегося вещества. На это затрачивается гораздо меньше времени, чем на взвешивание отдельных порций вещества. Отмеривание заданных объемов растворов проводится при использовании химических препаратов в быту, дозировке лекарств и пр. Широко известными приспособлениями для отмеривания растворов являются мерные цилиндры и мензурки (рис. 12.2).
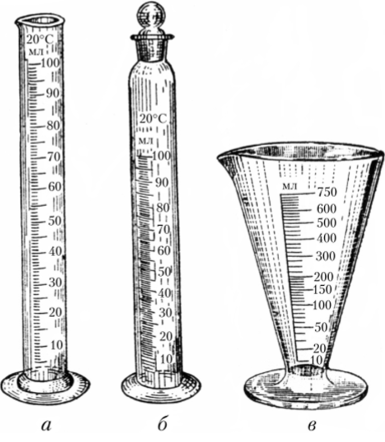
Рис. 12.2. Мерные цилиндры (а, 6) и мензурка (в) На проведении химических реакций в растворах при условии точного определения объемов растворов основан широко распространенный метод химического анализа, называемый объемным анализом. Для анализа применяется особо точная мерная посуда. Растворы заданного объема готовят в мерных колбах (рис. 12.3), внося в них точную навеску вещества в виде кристаллов или концентрированной жидкости и наполняя растворителем до кольцевой метки. В качестве примера будем считать, что в мерной колбе растворена химически чистая соль тетраборат натрия Na2B407— ЮН20. От приготовленного раствора можно отбирать небольшие объемы с помощью мерных пипеток (рис. 12.4) и переносить в какие-либо сосуды, например небольшие конические колбочки.
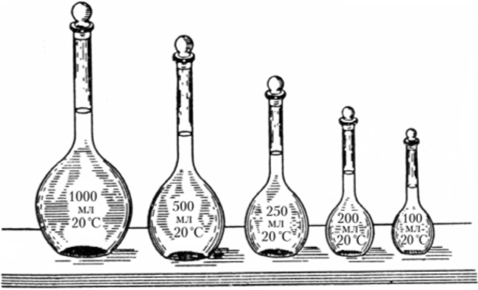
Рис. 12.3. Мерные колбы.

Рис. 12.4. Мерные пипетки:
а — пипетка Мора; б — градуированная пипетка; в — установка мениска жидкости на метке.

Рис. 12.5. Бюретка на штативе и колба для титрования.
С растворенным веществом в колбочке можно проводить химическую реакцию, медленно добавляя раствор некоторого реагента. Для этой цели служит бюретка, представляющая собой градуированную стеклянную трубку с краном или зажимом на конце (рис. 12.5). Перед началом опыта бюретку заполняют раствором до нулевого деления. Допустим, что в бюретке находится раствор соляной кислоты неизвестной концентрации.
При добавлении его к раствору тетрабората натрия идет химическая реакция 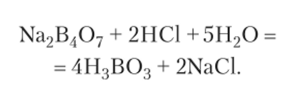
Кислоту приливают к тетраборату натрия постепенно, сначала по 2—3 капли, а в конце по одной капле. Этот процесс называется титрованием. Для наблюдения за ходом реакции в раствор тетрабората натрия вносят каплю индикатора. Если взят индикатор метиловый оранжевый, то раствор в колбочке становится желтым. Как только добавлено количество кислоты, достаточное для завершения реакции с имеющимся количеством Na2B407, малейший избыток кислоты вызывает изменение окраски индикатора от желтой к розовой. Добавление кислоты сразу же прекращают и по делениям бюретки отсчитывают затраченный объем. Описанный опыт позволяет определить объемы двух растворов, в которых вещества прореагировали без остатка. При этом концентрация одного вещества — Na2B407 — была заранее известна. Концентрацию второго вещества — НС1 — теперь можно рассчитать по стехиометрическому правилу:
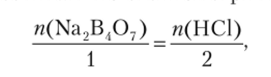
выражая количество каждого вещества через концентрацию и объем (см. ниже). Описанный опыт дает представление о сущности объемного химического анализа. В аналитической химии тщательно разработаны методики проведения всех этапов анализа для огромного количества веществ и удобные методы расчета результатов.