Метод валентных схем (валентных связей)

Характерной особенностью соединений, в которых имеет место донорно-акцепторная связь, является наличие группировок, между которыми происходит передача электронной пары с орбиталей донора (как правило, лиганда) на вакантную орбиталь акцептора (как правило, центрального атома) с образованием общей орбитали или системы орбиталей. Разновидностью донорно-акцепторной является семиполярная связь… Читать ещё >
Метод валентных схем (валентных связей) (реферат, курсовая, диплом, контрольная)
Метод валентных схем или связей (МВС) — квантово-химический метод расчета электронных волновых функций молекул1.
Мак-Вини Р., Сатклиф Б. Квантовая механика молекул. М.: Мир, 1972.
Важным достижением МВС был расчет молекулы водорода В. Гайтлером и Ф. Лондоном (1927). Ими найдено, что качественно правильный вид зависимости энергии от межатомного расстояния получается с так называемой ковалентной волновой функцией, выражаемой через атомные орбитали 15-типа Ха и Хм разных атомов в молекуле Н2, ядра которых обозначены индексами а и Ь
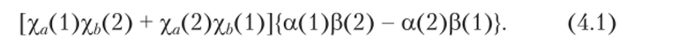
Здесь цифрами 1 и 2 обозначены переменные, имеющие место для а (К) и р (К) электронов (К = 1, 2) — спиновых функций при разных значениях спина К-го электрона.
В (4.1) принимается, что один из электронов находится возле ядра а, а другой — возле ядра Ь. Если заменить выражение в квадратных скобках на [х"0)Х"(2) + Х/>(2)Х/Х 1)]" то получается так называемая ионная волновая функция, для которой наиболее вероятно нахождение обоих электронов возле одного и того же ядра. Выражение в фигурных скобках в формуле (4.1) называется спиновой функцией, отвечающей спариванию электронов.
Возможность описания ковалентной связи одной ковалентной функцией в случае водорода способствовала развитию теории спин-валентности, согласно которой ковалентная связь обусловлена спариванием электронов. Классической структурной формуле молекулы соответствует при этом волновая функция, представляемая произведением функций вида (4.1), отвечающих отдельным валентным штрихам. Если молекуле отвечает несколько эквивалентных структур, более точную оценку энергии получают вариационным методом, когда волновую функцию молекулы Ч* представляют в виде линейной комбинации функций отдельных структур, а изменению энергии сопоставляют резонанс структур.
Упомянутый резонанс рассматривается в рамках теории резонанса[1] Л. Полинга (идея 1928 г.). Она сочетает представления классической теории химического строения с квантово-химическим описанием связи (в рамках МВС). Согласно теории резонанса, для молекул и ионов строение может быть представлено в виде нескольких структурных формул, взятых с определенным «весом» и отличающихся способом распределения электронных пар между ядрами; реальное электронное и геометрическое строение является промежуточным между ними. «Вес» каждой структуры определяется ее природой и относительной стабильностью.
В молекулах, включающих атомы с различной электроотрицательностью, значительный вклад вносят резонансные структуры ионного типа. Так, строение С02 описывается резонансом трех структур
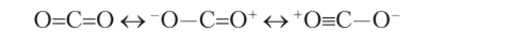
Межъядерное расстояние С—О в этой молекуле значительно меньше, чем в других молекулах со связями С=0.
Резонанс структур ведет к стабилизации основного состояния молекулы или иона. Мерой стабилизации служит энергия резонанса, которая тем больше, чем больше число резонансных структур и больше низкоэнергетичных эквивалентных структур участвует в резонансе. Энергию резонанса можно оценить как разность энергий основного состояния молекулы и ее изолированных связей или основного состояния и структуры сравнения, моделирующей наиболее устойчивую резонансную форму.
В теории резонанса используется понятие о гибридизации связей (Полинг Л.[2], 1931).
По В. И. Пупышеву, «сущность гибридизации состоит в том, что электрон молекулы вблизи выделенного атомного ядра характеризуют не отдельной атомной орбиталью, а линейной комбинацией атомных орбиталей с различными значениями азимутального и магнитного квантовых чисел. Такая линейная комбинация называется гибридизованной орбиталью». Считается, что между этим описанием и выравниванием межъядерных расстояний и валентных углов при образовании химических связей $-, р-} d- и т. д. электронами имеется прямая корреляция.
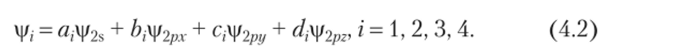
К примеру, в метане (5р3-гибридизация, рис. 4.1) атом углерода образует четыре связи, находясь в возбужденном состоянии с электронной конфигурацией s[3]2s2p3. Состояние четырех валентных электронов 2s2p3 описывают различные одноэлектронные функции i|/2s, чi2px, v)f2pz, i|12ру после гибридизации — функции, представляющие собой эквивалентные линейные комбинации упомянутых функций:
Максимумы у, направлены в сторону образования связи (к вершинам тетраэдрической молекулы). Считается, что в результате гибридизации образуется более прочная связь, а энергия системы понижается.
Заметим, что представления о возбуждении электронных состояний здесь не являются случайными. Первая ступень расчетной процедуры в МВС — промотирование электронов на возбужденные уровни. Именно еитуация на этой стадии расчета в свое время явилась одним из серьезных аргументов для отказа от применения МВС в пользу использования метода молекулярных орбиталей для описания химической связи во фторидах ксенона. Промотирование валентных электронов с орбиталей ксенона в этом случае требует крайне высоких энергий, которые не окупаются при образовании химической связи (Дяткина М. Е., 1969).
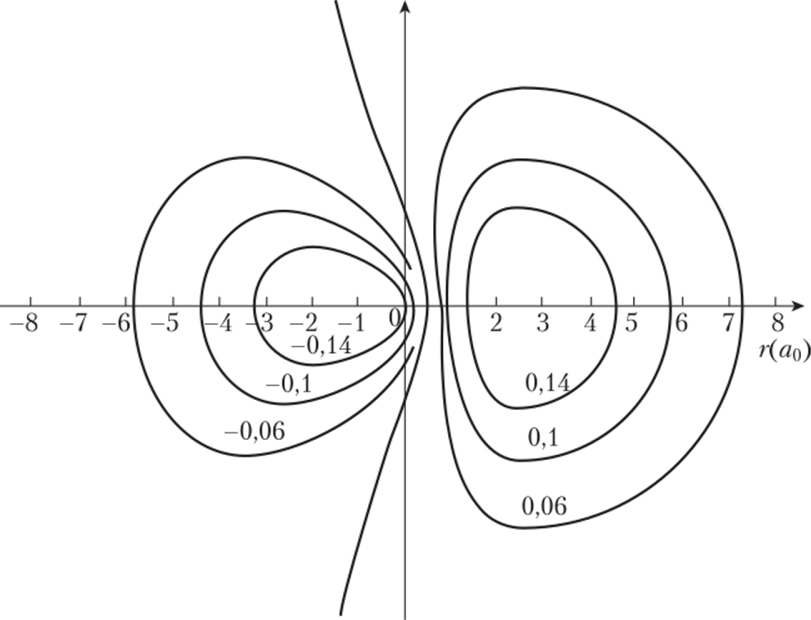
Рис. 4.1. Контурная диаграмма гибридной $/*3-орбитали В табл. 4.1 представлены некоторые виды гибридизации, включая тот случай, когда комплексообразователь использует свои d-орбитали.
В общем случае ЧДМХ*) (Чаркин О. П., 1973) записывается в виде комбинации функций, отвечающих ковалентным и ионным структурам. Однако определение их весовых коэффициентов возможно только из неэмпирических расчетов по М ВС, что представляет сложную задачу и выполнено лишь для небольшого числа простейших молекул. Даже если ограничиться ковалентными структурами, Ч/К ()11(МХ|<) оказывается очень сложной, поскольку представляет собой линейную комбинацию детерминантов, каждому из которых отвечает определенная схема спаривания, так, чтобы суммарный спин отвечал спину основного состояния молекулы, а Ч7 принадлежала полносимметричному представлению точечной группы симметрии. Поэтому на каждый способ спаривания обычно накладывают ограничения, с помощью которых удается выделить часть детерминантов, дающих наибольший вклад в ^ков(МХА).
Таблица 4.1
Тины гибридизации.
Гибридизация. | Конфигурация. | Примеры. |
sp | Линейная. | |Ag (CN)2]. |
*Р[4] | Треугольная. | [N03]. |
sp3 | Тетраэдр | |NH41+, [CoCl4][4]'. |
dsp[4] | Квадрат. | |
dsp' | Тригональная бипирамида. | [Et3P]2[NiBr3]°. |
cPs | Тетраэдр | [Cr04][4] |
(Psp3, sp^d1 | Октаэдр | [Co (NH3)6]3+, [Mn (CNS)6]4~. |
Здесь различают несколько случаев. Один из них — это т.н. валентное состояние полного спаривания, когда спин электрона на гибридной а,-АО атома М спаривается только со спином электрона на /,-АО i-го лиганда X, в сторону которого и направлена а,. Тогда для энергии атомизации (DatMXk) имеем:
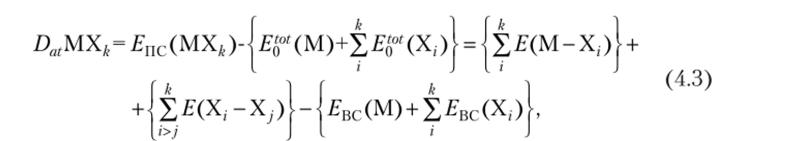
где ?ВС(М) и ?ВС(Х,) — энергии возбуждения валентного состояииях атомов М и X; ?пс — энергии полного спаривания, а в фигурных скобках приведена полная энергия межатомных взаимодействий, т. е. энергия, которая выделилась бы при образовании молекулы из атомов, предварительно возбужденных каким-либо способом в ВС.
В базисе комплексных АО энергия ?иПС выражается в виде линейной комбинации энергий термов спектроскопических состояний Ф: ?Ы1С = Yjal, s[10][4]? (L[4], Lz, S[4], Sz), а последние могут быть.
L, S.
взяты из данных атомной спектроскопии. Здесь aLS — коэффициенты разложения, которые можно определить в рамках метода «атом в молекуле»[4] либо, но теории групп.
В. С. Урусов даст пример, иллюстрирующий механизм формирования валентного состояния для атома углерода с конфигурацией основного состояния 2s22p2 и тетраэдрической гибридизацией sp3. При этом учитываются:
- • промотирование 2s22p2 => 2sx2p3 (с переходом электрона с основного состояния центрального атома — здесь это углерод на возбужденное);
- • гибридизация электронов;
- • разупорядочение спинов валентных электронов, так как в валентном состоянии все спины компенсированы.
Энергия, затрачиваемая на организацию валентного состояния, для атома углерода составляет 162 ккал/г-атом, причем промотирование требует затраты в 96 ккал/г-атом. В результате перехода в валентное состояние потенциалы ионизации принимают значения, отличные от ступенчатых потенциалов ионизации, табулированных во многих справочниках (они базируются преимущественно на обзорах III. Мур, National Bureau of Standard USA, 1950—1960;err.).
Итак, MBC предполагает, что химическая связь является двухэлектронной и направленной, причем это предположение распространяется на комплексные соединения.
Продемонстрируем способ описания связи по МВС на трех примерах.
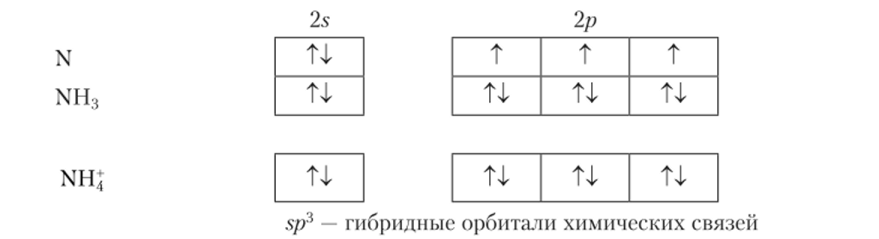
Ион аммония. Его образование связывают с $/?3-гибридизацией. Атом азота имеет 3 неспаренных электрона, дающие a-связи с s-электронами трех атомов водорода. Ион имеет так называемую неподеленную электронную пару (2s2), не использованную для связи с другими атомами или ионами. Неноделенная пара осуществляет связи с четвертым атомом водорода. При этом происходит гибридизация трех 2/?-орбиталей и 2s-op6iiTa.in комплексообразователя (азота), причем гибридные орбитали направлены к вершинам тетраэдра, в центре которого находится азот. Все гибридные орбитали взаимодействуют с ls-орбиталями лигандов, в результате чего образуются 4 одинаковых двухэлектронных а-связи иона аммония.
Как видно, МВС активно использует идею о донорно-акцепторной связи, так как одна из связей образована путем передачи части электронной плотности неподеленной пары на ls-орбиталь лиганда.
С помощью условных изображений орбиталей в виде «квантовых ячеек» образование иона аммония может быть показано следующим образом:
Для-переходных металлов по МВС возможно существование двух типов комплексов — ионных и ковалентных или спин-свободных и спин-связанных.
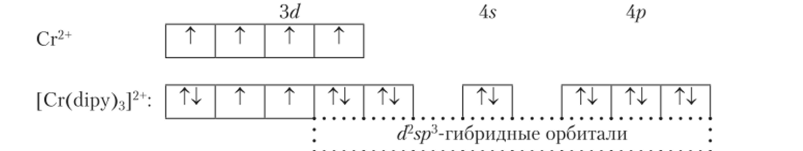
Снин-связанные (внутриорбитальные или ковалентные) комплексы. Комплекс двухвалентного хрома с а, а-дипиридилом [Cr (dipy)3]2+. Возбуждение конфигурации приводит к спариванию одного электрона и высвобождению двух «ячеек» для размещения в них двух пар электронов лиганда:
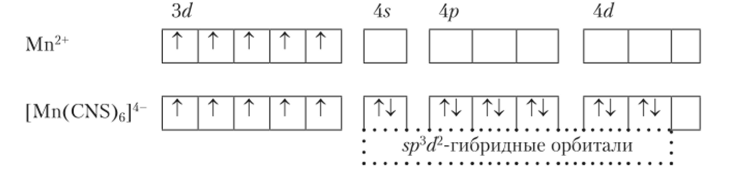
Спин-свободные (внешнеорбитальные или ионные) комплексы. Гексароданокомплекс Мп (Н). Электроны на 3^-уровне не затрагиваются, но зато две электронные пары лигандов занимают более высоколежащий и виртуальный 4б/-уровень:
Здесь очевиден произвол в выполнении процедуры, который устраняется привлечением дополнительных сведений, например, полученных по данным статической магнитной восприимчивости. Подчеркнем, что процедура для объяснения тех же магнитных свойств вполне приемлема, однако сомнительна в предсказательном ключе.
МВС позволяет объяснить магнитные свойства веществ. Наличие спаренных электронов означает диамагнитное состояние. Существование в электронной оболочке комплекса неспаренных электронов может приводить к парамагнитному состоянию вещества, и комплекс имеет ненулевой магнитный момент. Магнитный момент вещества р, выраженный в магнетонах Бора1 (рв, или М. Б.), можно рассчитать, но формуле: 1 = у]п (п + 2), где п — число неспареиных электронов.
В качестве примера рассмотрим комплексные ионы | Mn (CN)6]4_ и [Mn (CNS)6]4_. Ион Mn (II) имеет пять неспаренных электронов. В случае cPsp3- и $р3</<sup>2-гибридизации возможно различное магнитное поведение этих комплексов. В первом случае соединение должно иметь р = 1,79 М. Б. Во втором — 5,92 М. Б. По данным эксперимента имеем:

1 магнетон Бора = 5580 Гс • см3/моль.
Можно заключить, что для иона [Mn (CN)6]4 имеет место г/25/;3-ги6ридизация, а для [Mn (CNS)6]4_ — 5р3бР-гибридизация.
Ряд исследователей, основываясь на МВС, выдвинули тезис о магнитном критерии характера химической связи, т. е. о наличии ковалентных или ионных связей в координационных соединениях. С этой точки зрения комплексные соединения с ионными связями должны иметь такой же магнитный момент, как и свободный ион. Спаривание же электронов свидетельствует о наличии ковалентных комплексов.
Поясним сказанное примером. Ион Fe (III) характеризуется 5 неспаренными электронами. Для комплекса [Fe (CN)6]3- число неспаренных электронов уменьшается до одного (этому отвечает р = 1,7—1,8 М. Б.). Таким образом, связи в этом ионе являются ковалентными. Для иона [FeF5(OII)2J2- м = 5,9, что совпадает с ожидаемым для 5 неспаренных электронов. Это должно свидетельствовать, что связи — ионно-дипольные, т. е. осуществляются только за счет электростатического взаимодействия между центральным ионом и лигандами. По этот прием не всегда работает. Так, например, для [Fe (acac)3]3+ по магнитным данным р=5,9 М. Б., т. е. он должен считаться ионным. Однако он проявляет свойство ковалентного комплекса: растворяется в органических растворителях и не является электролитом.
Нетрудно видеть, что метод валентных связей практически непосредственно базируется на концепции Льюиса. На той же концепции основываются и представления о донорно-акцепторной связи.
Характерной особенностью соединений, в которых имеет место донорно-акцепторная связь, является наличие группировок, между которыми происходит передача электронной пары с орбиталей донора (как правило, лиганда) на вакантную орбиталь акцептора (как правило, центрального атома) с образованием общей орбитали или системы орбиталей. Разновидностью донорно-акцепторной является семиполярная связь, к примеру, в соединениях типа R3P+— СН2, R3N+—О, образованная за счет переноса одного электрона от донора к акцептору с последующим спариванием неподеленных электронов и формированием общей связывающей орбитали а-типа.
В принципе, природа донорно-акцепторной связи не отличается от обычной полярной ковалентной, т. е. локализованной и направленной связи. Различие заключается лишь в описании образования этих связей.
И. Берсукер предлагает сохранить термин «донорно-акцепторная связь» для характеристики генеалогии электронов связи, поскольку классификация связей по происхождению и предыстории соединения в определенной мере отражает процесс его синтеза. Но-видимому, с этим можно согласиться, так как такой подход до сих пор не потерял своего значения для экспериментальной химии, по крайней мере в случае соединений, для которых можно говорить о направленных связях, и для реагирующих систем, в которых отсутствует реакционная поверхность раздела фаз.
- [1] Справедливый вопрос о понимании теории резонанса и о соотношении квантово-химических методов с классической теорией в свое время явились предлогомдля политической критики некоторых отечественных химиков-органиков и теоретиков (см. Стенографический отчет Всесоюзн. совещания 11 — 14 июня 1951 г."Состояние теории химического строения в органической химии". М.: Изд. АНСССР, 1952).
- [2] В дальнейшем представления о гибридизации получили развитие и в насто
- [3] ящее время являются самостоятельным методическим приемом квантовой химии.
- [4] Moffitt W. //Ргос. Roy. Soc 1950. V. А317. Р. 341.
- [5] Moffitt W. //Ргос. Roy. Soc 1950. V. А317. Р. 341.
- [6] Moffitt W. //Ргос. Roy. Soc 1950. V. А317. Р. 341.
- [7] Moffitt W. //Ргос. Roy. Soc 1950. V. А317. Р. 341.
- [8] Moffitt W. //Ргос. Roy. Soc 1950. V. А317. Р. 341.
- [9] Moffitt W. //Ргос. Roy. Soc 1950. V. А317. Р. 341.
- [10] Валентное состояние центрального атома может быть получено при гипотетическом процессе удаления от центрального атома лигандов без изменения способа спаривания (модель «замороженных орбиталей» Моффита — Ван Флека).
- [11] Moffitt W. //Ргос. Roy. Soc 1950. V. А317. Р. 341.
- [12] Moffitt W. //Ргос. Roy. Soc 1950. V. А317. Р. 341.
- [13] Moffitt W. //Ргос. Roy. Soc 1950. V. А317. Р. 341.
- [14] Moffitt W. //Ргос. Roy. Soc 1950. V. А317. Р. 341.