Осмос и осмотическое давление
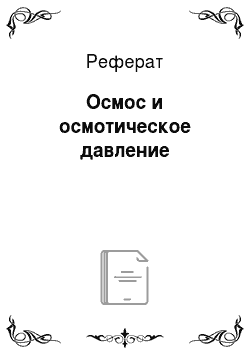
Непрерывным движением молекул в жидких растворах обусловлено явление диффузии. При наличии в растворе неоднородности, например двух слоев с разными концентрациями и плотностями (рис. 12.9), частицы растворенного вещества преимущественно перемещаются в направлении слоя раствора с меньшей концентрацией. Можно визуально наблюдать постепенное перемещение интенсивно окрашенной зоны раствора вверх… Читать ещё >
Осмос и осмотическое давление (реферат, курсовая, диплом, контрольная)
Непрерывным движением молекул в жидких растворах обусловлено явление диффузии. При наличии в растворе неоднородности, например двух слоев с разными концентрациями и плотностями (рис. 12.9), частицы растворенного вещества преимущественно перемещаются в направлении слоя раствора с меньшей концентрацией. Можно визуально наблюдать постепенное перемещение интенсивно окрашенной зоны раствора вверх. Граница между слоями раствора становится все более расплывчатой, и падение концентрации от максимальной до минимальной по высоте происходит постепенно. В обратном направлении идет диффузия молекул растворителя. Скорость диффузии зависит от перепада (градиента) концентраций, размеров молекул, вязкости среды и температуры.
Диффузией называется явление самопроизвольного переноса вещества в жидкости или газе из области с большей концентрацией в область с меньшей концентрацией.
Представим себе теперь, что бесцветный раствор сахара и вода разделены пористой перегородкой, через которую могут проходить только молекулы растворителя, но нс проходят молекулы сахара. Один из давно известных способов изготовления такой перегородки состоит в том, что пористый керамический сосуд, пропитанный раствором сульфата меди, погружают в раствор желтой кровяной соли K4[Fe (CN)6]. В порах цилиндра образуется нерастворимая комплексная соль Cu2[Fe (CN)6]. Размеры пор в этом осадке таковы, что керамическая стенка сосуда приобретает свойство полупроницаемости. Возможно изготовление полупроницаемых перегородок из разнообразных материалов. Тонкие полупроницаемые перегородки называют мембранами. Оболочки растительных и животных клеток и внутриклеточные перегородки также являются полупроницаемыми мембранами, способными избирательно пропускать не только молекулы воды, но и некоторые другие молекулы и ионы.
Если в сосуд, обработанный, как описано выше, налить раствор сахара и погрузить сосуд в воду (рис. 12.10), то через мембрану будут проходить только молекулы воды. Скорость переноса воды окажется больше в направлении из чистой воды в раствор сахара. Вследствие этого объем раствора постепенно увеличивается, а концентрация его уменьшается. Наблюдаемое явление называется осмосом. Осмос идет также между двумя растворами разной концентрации, если они помещены по разные стороны мембраны. Растворитель переходит из раствора с меньшей концентрацией растворенного вещества в раствор с большей концентрацией. В этом случае перенос растворителя заканчивается при выравнивании концентрации растворов.
Осмос — это явление самопроизвольного переноса растворителя через полупроницаемую мембрану из чистого растворителя в раствор или из раствора с меньшей концентрацией растворенного вещества в раствор с большей концентрацией.
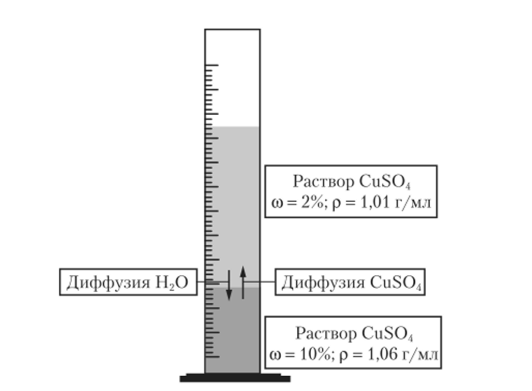
Рис. 12.9. Диффузия сульфата меди в растворе с перепадом концентрации.
Осмос играет очень важную роль в жизни животных и растительных организмов. Если клетка окружена жидкостью с небольшой концентрацией растворенных веществ, то вода переносится из среды в клетку, увеличивая объем цитозоля и растягивая оболочку клетки. В результате клетка поддерживается в напряженном состоянии. Вот почему такие мягкие части растения, как травянистые стебли, листья, лепестки цветов обладают упругостью. У срезанного растения вследствие испарения воды объем цитозоля уменьшается, оболочки клеток теряют натяжение, и растение вянет. Но стоит только.
начавшее вянуть растение поставить в воду, как возникает осмос, оболочки клеток снова напрягаются и растение принимает прежний вид.
В медицине строго соблюдается требование изотоничности, т. е. одинакового осмотического давления, биологических жидкостей и инъекционных растворов.
При сильном разбавлении крови водой начинается разрушение (гемолиз) кровяных клеток вследствие осмотического переноса воды внутрь клеток. Кровяные клетки, помещенные в раствор с высокой концентрацией, например 5%-ный раствор хлорида натрия, теряют воду вследствие осмоса и сжимаются — происходит плазмолиз. Эти явления предотвращаются внутривенным введением лекарств в изотоническом растворе. Изотопическим по отношению к крови является 0,9%-ный раствор хлорида натрия в воде.
(плотность раствора 1,005 г/мл). рис. 12.Ю. Осмос:
На рис. 12.10 показано, что раствор, вода проникает в раствор через объем которого увеличивается в резульполупроницаемую стенку тате осмоса, постепенно поднимается, но трубке. Столб жидкости, возвышающейся над наружной поверхностью воды, создает гидростатическое давление, направленное против движущей силы осмоса. При достаточном поднятии жидкости по трубке осмос прекращается. Давление столба жидкости начинает выталкивать растворитель через мембрану с такой же силой, с какой растворитель проникает в раствор. Устанавливается осмотическое равновесие. В этом состоянии давление столба жидкости равно движущей силе осмоса, называемой осмотическим давлением л.
Величина осмотического давления была исследована методом уравновешивания осмоса приложенным внешним давлением с применением осмометров, в принципе не отличающихся от прибора на рис. 12.10. Исследования разных растворов показали, что в случае разбавленных растворов осмотическое давление не зависит от природы растворенного вещества и растворителя. Оно прямо пропорционально молярной концентрации раствора и абсолютной температуре: 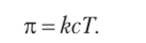
Коэффициент k оказался одним и тем же для разных растворителей и растворенных веществ (в этом и проявляется независимость осмотического давления от природы раствора). Интереснее всего то, что численное значение этого коэффициента совпадает с универсальной газовой постоянной R = 8,31 лкПа моль-1 • К-1. Таким образом, можно написать окончательное уравнение 
Учитывая, что молярная концентрация с = п/ У, мы можем убедиться, что уравнение (12.6) формально не отличается от уравнения состояния идеального газа:
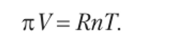
Сходство уравнений для расчета давления газа и осмотического давления, обнаруженное голландским ученым Я. Вант-Гоффом (1852—1911), позволило ему дать следующую формулировку закона осмотического давления (закона Вант-Гоффа).
Осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора.
Пример 12.12. Какое осмотическое давление может производить одномолярный (1 моль в 1 л) раствор сахарозы?
Решение. Если взять газ, 1 моль которого сжат до объема 1 л при 0 °C, то давление газа составит 22,4 атм, так как при давлении 1 атм газ занимал бы объем 22,4 л. Таким образом, по закону Вант-Гоффа раствор, данный в условии задачи, мог бы производить осмотическое давление 22,4 атм. Это весьма большое давление; оно приблизительно равно давлению воды на глубине 220 м.
Необходимо, однако, подчеркнуть, что, несмотря на полную аналогию числовых зависимостей, механизмы газового и осмотического давлений совершенно различны. Раствор в обычном сосуде никак не проявляет своего осмотического давления. Но представим себе раствор с концентрацией 1 моль/л, помещенный в полупроницаемую сферическую оболочку из керамики. Эту оболочку погружают в воду. Поскольку керамика не эластична, осмотический перенос воды внутрь оболочки очень быстро создаст осмотическое давление на внутреннюю поверхность 22,4 атм. Оболочка может не выдержать такого давления и разрушиться раньше, чем установится осмотическое равновесие.
Расчеты по закону Вант-Гоффа дают точные результаты только для разбавленных растворов. В концентрированных растворах наблюдаются значительные отклонения от измеренных на опыте значений. Особенно сильные отклонения обнаруживаются в водных растворах электролитов — веществ, проводящих электрический ток в водном растворе, о чем подробно будет сказано в гл. 13.
На основе зависимости между молярной концентрацией и осмотическим давлением раствора можно по измеренному значению тт вычислять молярные массы таких веществ, которые не могут быть переведены в газообразное состояние, но образуют растворы в тех или иных растворителях.
Пример 12.13. 3 г неизвестного вещества растворили в 500 мл воды. Измеренное осмотическое давление этого раствора при 20 °C составило 243,6 кПа. Вычислите молярную массу вещества.
Решение. Преобразуем уравнение Вант-Гоффа, подставив с = m/(MV):
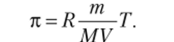
Отсюда получаем выражение для расчета молярной массы: Производим вычисления: 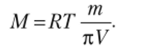
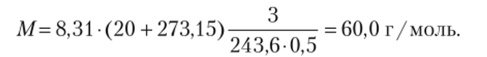
Возможно, что это вещество карбамид CO (NH2)2.