Реакции образования малорастворимых солей и гидроксидов

Соли, не содержащие одноименных ионов по отношению к малорастворимому электролиту, тоже влияют на растворимость, но в этом случае наблюдается увеличение растворимости. Растворимая в воде соль, являясь сильным электролитом, придает раствору определенную ионную силу, вследствие чего понижается активность ионов малорастворимой соли. Появляется возможность растворения дополнительного количества… Читать ещё >
Реакции образования малорастворимых солей и гидроксидов (реферат, курсовая, диплом, контрольная)
На образовании осадков при смешивании растворов солей и гидроксидов основаны простейшие химические исследования. Они позволяют установить присутствие или отсутствие в растворах тех или иных катионов и анионов. Осаждение веществ по обменным реакциям из растворов применяется также для получения мелкодисперсных препаратов. Карбонат кальция для зубной пасты производится не размалыванием природного мела, а осаждением из раствора по реакции между хлоридом кальция и карбонатом натрия.
Нерастворимые в воде вещества образуются в результате ионного обмена между исходными ионными веществами. Ионообменные реакции являются кислотно-основными, если рассматривать их с позиций электронной теории Льюиса. Катионы играют роль акцепторов электронных пар, т. е. кислот, а анионы — доноров, т. е. оснований.
Нерастворимые вещества — это условное понятие, означающее очень малую растворимость — менее 0,01%. На самом деле между жидкой фазой (водой) и твердой фазой (осадком) устанавливается равновесие, и определенное количество «нерастворимого» вещества все-таки присутствует в растворенном состоянии. Если вещество имеет ионную кристаллическую структуру, то в раствор оно переходит в виде ионов, и растворение можно представить в виде реакции.
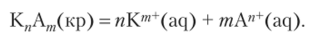
Эта реакция характеризуется константой равновесия, называемой константой растворимости: 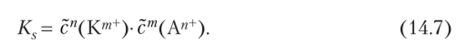
Уравнение ЗДМ (14.7) записано без знаменателя, так как концентрация твердого вещества, согласно принятому ранее условию, считается равной единице. Константы растворимости некоторых малорастворимых солей приведены в табл. 14.5.
Таблица 145
Константы растворимости некоторых солей и гидроксидов.
Вещество. | K,. |
AgBr. | 5,3 10 13 |
Ag2C ()3 | 8,46 10 12 |
AgCl. | О О. г; |
Agl. | 8,52 10 17 |
AgN ()2 | 1.6 10 4 |
Ag3P04 | 8,89 1017 |
Ag2S04 | 1,2−10 5 |
BaC03 | 2,58−10 9 |
BaC204 | 1,1−10 7 |
BaF2 | 1,84 10 7 |
BaS03 | 5,0 10 10 |
BaS04 | 1,08−10 10 |
CaC03 | 3,36 10 9 |
CaC204 | 2,32−10-®. |
CaF2 | 3,45−10 11 |
Вещество. | K,. |
Са (ОН)2 | 5,02 -10 6 |
Са3(Р ()4)2 | 2,07−10-33 |
CaS04-2H20. | 3,14−10'5 |
CuS. | 6,3−10 36 |
Fc (()H)2 | 4,87−1017 |
Fe (OH)3 | 2,79 10 39 |
FeS. | 5−1018 |
KC1()4 | 1,05−10-2 |
LiOH. | 4−10 2 |
U3P04 | 2,37−10 11 |
Mg (OH)2 | 5,61 -10 12 |
PbCl2 | 1,7−10 5 |
PbF2 | 3,3 -10 8 |
Pbl2 | 9,8−10 a |
ZnC03 | 1,46 10 10 |
Малорастворимая соль характеризуется малой константой растворимости.
При смешивании растворов, содержащих по отдельности ионы, образующие нерастворимое вещество, возникает неустойчивый пересыщенный раствор и, как правило, в тот же момент образуется твердая фаза, переходящая в осадок. Вместо осадка иногда образуется коллоидный раствор.
Осадок образуется при Пс > Ks.
Осадок не образуется или растворяется, если он есть, при Пс < Ks. Состояние равновесия (насыщенный раствор) наступает при Пс = Ks.
Выведем уравнения, связывающие растворимость и константы растворимости для электролитов наиболее часто встречающегося ионного состава КА и К2А (КА2). Формулы и расчеты приведены в табл. 14.6.
Таблица 14.6
Связь между константами растворимости и растворимостью для солей типа КА и КА2
Соль. | Оксалат кальция. | Фторид кальция. |
Формула. | СаС204 (тип КА). | CaF2 (тип КА2). |
Реакция растворения. | СаСА = Са2+ + С20|; | CaF2 = Са2+ + 2F" . |
Начальные концентрации. | 1 0 0. | 1 0 0. |
Равновесные концентрации. | 1 s S | 1 5 2s |
ЗДМ. | Ks = с (Са2+) — с (С20|) или Ks = s2 | Ks= с (Са2+) — c2(F) или К, = 4s3 |
Ks по справочнику. | Ks = 2,32−10~9 | Ks = 3,45- 10″ . |
Вычисление растворимости, моль/л. | 5 = ^ =4,82−105 | s = ?|—— =2,01 • 10-4 |
Мг соли. | ||
Растворимость, мг/л. | 6,17. | 16,0. |
По данным табл. 14.6 можно сделать следующие выводы:
- — выражение ЗДМ для равновесия растворимости зависит от ионного типа соли;
- — растворимость солей разного ионного типа рассчитывается по разным формулам;
- — сравнивать растворимость по значениям констант растворимости можно только для солей одного и того же ионного типа. В разобранных примерах соль с меньшей константой растворимости оказалась более растворимой.
Растворимость солей К"А." вьшажается обшей формулой.
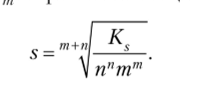
В присутствии растворимой соли с одноименными ионами по отношению к малорастворимой соли растворимость этой соли понижается.
Пример 14.10. Рассмотрим раствор оксалата натрия (концентрация ОД моль/л) с осадком оксалата кальция. Какова растворимость оксалата кальция?
Решение. Раствор с самого начала содержит оксалат-ионы, с0(С20|) = = 0,1 моль/л. При насыщении этого раствора оксалатом кальция в растворе появятся ионы Са2+ в концентрации s' и на такую же величину повысится концентрация оксалат-ионов. Напишем выражение ЗДМ:
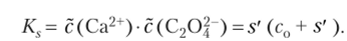
Пренебрегая малым значением 5' по сравнению с с0, получим.
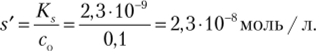
Растворимость оксалата кальция в растворе оксалата натрия по сравнению с растворимостью в чистой воде (см. табл. 14.6) уменьшилась приблизительно в 2000 раз вследствие смещения равновесия.
влево.
Соли, не содержащие одноименных ионов по отношению к малорастворимому электролиту, тоже влияют на растворимость, но в этом случае наблюдается увеличение растворимости. Растворимая в воде соль, являясь сильным электролитом, придает раствору определенную ионную силу, вследствие чего понижается активность ионов малорастворимой соли. Появляется возможность растворения дополнительного количества соли — растворимость повышается.
Явление увеличения растворимости в присутствии посторонних солей называется солевым эффектом.
Ионообменная реакция может идти между веществом в растворе и осадком малорастворимого вещества. Реакция этого типа между двумя солями идет медленно. Направление такой реакции зависит от констант растворимости исходного осадка и продукта реакции. Рассмотрим реакцию между нерастворимым сульфатом бария и раствором карбоната натрия. Будет ли идти замещение одного осадка на другой? Напишем реакцию и условно разделим ее на стадию растворения исходного вещества и стадию образования нового осадка:
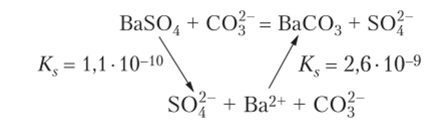
Константа равновесия последовательных реакций равна произведению констант отдельных стадий. Для второй стадии следует взять обратное значение константы, так как процесс рассматривается не в направлении растворения, а в направлении осаждения. Вычисляем константу суммарной реакции:
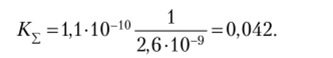
Константа равновесия меньше единицы приблизительно в 50 раз. Равновесие сдвинуто влево, и процесс, в соответствии с ЗДМ может идти лишь до тех пор, пока концентрация переходящих в раствор ионов SO|" не превысит — 1 /24 от концентрации СО3″. Для достаточно полного превращения осадка сульфата бария в карбонат бария потребовалось бы или взять большой избыток раствора карбоната натрия, или несколько раз сменить раствор над осадком. Иначе происходили бы обменные реакции осадков BaS04 и ВаСОэ с сильной кислотой, например НС1. Сульфат бария не растворяется в кислоте, так как имеющиеся в растворе ионы Н+ не реагируют с анионами БО^осадка. В случае карбоната бария ионы Н+ образуют с ионами СО|~ слабую и неустойчивую угольную кислоту, что ведет к растворению осадка и выделению углекислого газа:
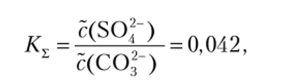
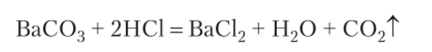
Сульфат бария как соль тяжелого элемента, сильно поглощающего рентгеновские лучи, применяется для рентгеноскопии желудка. Для этого больной должен принять значительную порцию густой суспензии сульфата бария. Применение для этой цели карбоната бария категорически не допустимо, так как эта соль реагировала бы с кислотой желудочного сока и опасные для жизни ионы бария попадали бы в кровь.