Характеристика и способы выражения концентрации растворов

Раствор состоит из растворителя и растворенного вещества. Если оба компонента раствора находятся в одинаковом агрегатном состоянии (например, смешали 20 г жидкого этанола и 50 г жидкого метанола), то растворителем будет тот компонент, масса которого больше (в нашем примере — метанол). Если же смешиваются компоненты в разных агрегатных состояниях (например, жидкая вода и твердый NaCl… Читать ещё >
Характеристика и способы выражения концентрации растворов (реферат, курсовая, диплом, контрольная)
Раствор — это гомогенная система, состоящая из двух и более компонентов и продуктов их взаимодействия. Например, водный раствор KCl. Здесь 2 компонента: вода и хлорид калия.
Растворы могут находиться в трех агрегатных состояниях:
твердые растворы или сплавы — например, сплав серебра и золота;
газообразные растворы или смесь газов — например, смесь азота и кислорода;
жидкие растворы, например, водный раствор сахара, кровь, моча, желудочный сок.
Раствор состоит из растворителя и растворенного вещества. Если оба компонента раствора находятся в одинаковом агрегатном состоянии (например, смешали 20 г жидкого этанола и 50 г жидкого метанола), то растворителем будет тот компонент, масса которого больше (в нашем примере — метанол). Если же смешиваются компоненты в разных агрегатных состояниях (например, жидкая вода и твердый NaCl), то растворителем будет тот компонент, который находится в том же агрегатном состоянии, что и полученный раствор (то есть вода).
Среди многих растворителей особое место занимает вода — это универсальный растворитель, который растворяет многие вещества. Вода — самый распространенный растворитель в промышленности, сельском хозяйстве, быту, медицине и фармации, при проведении химических опытов. Многие биологические жидкости (кровь, моча, желудочный сок и т. д.) — это водные растворы, содержащие все необходимое для жизнедеятельности живых организмов.
Способы выражения концентрации растворов.
Концентрация растворов — это есть содержание растворенного вещества (в молях или граммах) в определенном объеме или массе раствора или растворителя.
Существуют следующие основные способы выражения концентрации растворов:
Массовая доля растворенного вещества — это есть отношение массы растворенного вещества к массе раствора, то есть:
Например, 5 г NaOH содержится в 50 г раствора.
Тогда.
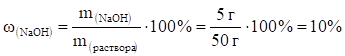
Необходимо помнить, что:
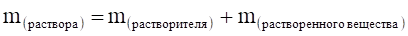
.
где.
Молярная концентрация (или молярность) — это отношение количества растворенного вещества () к объему раствора (V) или число молей растворенного вещества в 1 литре раствора. то есть:
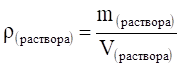
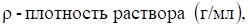
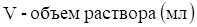
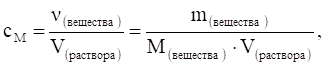
где m — масса растворенного вещества, М — молярная масса растворенного вещества (г/моль),.
V — объем раствора (л).
Например, в 500 мл раствора содержится 19,6 г H2SO4.
Тогда.
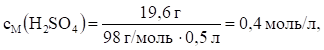
то есть в 1 литре раствора содержится 0,4 моль серной кислоты.
Молярная концентрация эквивалента растворенного вещества — это есть отношение количества эквивалентов (число молей эквивалентов) растворенного вещества к объему раствора (или число молей эквивалентов растворенного вещества в 1 литре раствора), то есть:
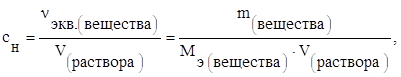
где Мэ — молярная масса эквивалента растворенного вещества.
Например, в 100 мл раствора содержится 9,8 г серной кислоты.
Тогда:

то есть в 1 литре раствора содержится 2 моль эквивалентов серной кислоты, то есть получился двухнормальный раствор серной кислоты.
Моляльная концентрация (или моляльность) — это есть количество (число молей) растворенного вещества в 1 кг растворителя (или в 1000 г растворителя), то есть:

Например, в 200 г воды (то есть растворителя) растворено 4 г NaOH.
Тогда то есть в 1 кг воды содержится 0,5 моля NaOH.
Молярная доля растворенного вещества — это отношение количества (числа молей) растворенного вещества к сумме количеств (к сумме молей) всех веществ, составляющих раствор, то есть:
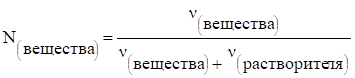
Например, 8 г NaOH растворено в 14,4 г воды.
Тогда.

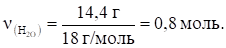
Отсюда:
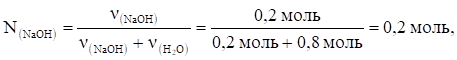
то есть молярная доля NaOH в растворе равна 0,2.
Титр раствора (Т) — это есть число граммов растворенного вещества в 1 мл раствора, то есть:
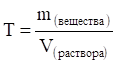
Например, в 100 мл раствора содержится 5 г серной кислоты.
Тогда.
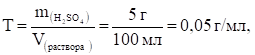
то есть в 1 мл раствора содержится 0,05 г серной кислоты.
Изменение энергии Гиббса, энтальпии и энтропии при образовании раствора.
Процесс растворения — это сложный физико-химический процесс, при котором наблюдается взаимодействие растворителя и растворенного вещества. Поэтому при растворении происходит как изменение энтальпии (Н), так и изменение энтропии (S).
При растворении твердого вещества в воде Н может быть как меньше нуля, так и больше нуля. Например, при растворении NaOH в воде тепло выделяется (Н0) и раствор нагревается. При растворении KNO3 в воде тепло поглощается (Н0) и раствор охлаждается.
При растворении газов в воде тепло как правило выделяется, то есть Н0.
Изменение энтропии при растворении твердых веществ (сахар, NaCl) в воде увеличивается (S0), так как при растворении беспорядок в системе увеличивается. При растворении газов в воде беспорядок в системе газ-вода уменьшается, поэтому энтропия тоже уменьшается (S0).
Направление процесса растворения и возможность его протекания определяется по изменению энергии Гиббса G:
Gрастворения = Hрастворения TSрастворения Процесс растворения вещества возможен и протекает самопроизвольно (например, сахар растворяется в воде), когда G0. Численное значение G показывает, как глубоко идет процесс растворения: чем отрицательнее G, тем образуется более устойчивый раствор.
Если при растворении достигнуто состояние, когда G = 0, то наступает состояние равновесия и дальше вещество растворяться не будет, то есть образовался насыщенный раствор.
Растворимость веществ.
Растворимость вещества — это способность вещества растворяться в том или ином растворителе до образования насыщенного раствора.
Количественно растворимость выражается коэффициентом растворимости — это есть масса вещества, способного растворяться в 100 граммах растворителя. Для газов иногда коэффициент растворимости выражают в мл газа, способного раствориться в 100 г растворителя (или в 1 литре растворителя) при данной температуре и давлении.
Растворимость веществ зависит от следующих факторов:
от природы растворенного вещества и природы растворителя. В этом случае полярные вещества (HCl, NaCl) лучше растворяются в полярных растворителях (вода), а неполярные вещества лучше растворяются в неполярных или малополярных растворителях.
от температуры. С повышением температуры путем нагревания растворимость большинства твердых веществ, как правило, увеличивается. Растворимость газов (Н2, О2) в воде с повышением температуры уменьшается.
от давления (для растворимости газов).
Влияние давления на растворимость газов в жидкости описывается законом Генри:
Растворимость газа в жидкости прямо пропорциональна давлению этого газа над жидкостью, то есть с = Кр, где р — давление газа (например, О2) над жидкостью (например, водой); с — растворимость газа, то есть число граммов газа в единице объема жидкости; К — коэффициент пропорциональности, называемый константой Генри. Он характеризует растворяющуюся способность данного газа: чем больше «К», тем данный газ лучше растворяется в данной жидкости.
Зависимость растворимости газовой смеси (например, О2 и N2 воздуха) в жидкости от парциального давления газа в этой смеси выражает закон Генри-Дальтона:
Растворимость каждого компонента газовой смеси прямо пропорциональна парциальному давлению этого компонента в газовой смеси, то есть:
сi = Кi рi,.
раствор гомогенный газовый где сi — растворимость i-того компонента;
рi — парциальное давление i-того компонента в газовой смеси.
Например, если газовая смесь состоит из О2 и N2, то можно написать:
Из закона Генри-Дальтона следует, что чем больше парциальное давление компонента в газовой смеси, тем больше его растворимость в жидкости (например, воде).
Присутствие электролита (NaCl, NaOH) в воде уменьшает растворимость газов. Зависимость растворимости газа от концентрации электролита в растворе выражает закон И. М. Сеченова:
Растворимость газа в чистом растворителе больше, чем в растворе электролита, то есть:
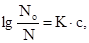
где: No — молярная доля газа в чистом растворителе (например, О2 в чистой воде);
N — молярная доля газа в растворе электролита (например, О2 в водном растворе NaCl);
с — концентрация электролита в растворе (например, NaCl в воде);
К — коэффициент пропорциональности.
Из уравнения видно, что чем больше концентрация электролита в растворе ©, тем меньше газа растворяется в данном растворе (то есть меньше N).