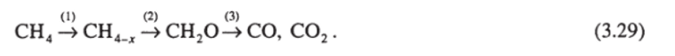В литературе можно найти и чисто гетерогенные схемы механизма окисления метана в формальдегид без участия свободных радикалов. В работе по окислению метана на различных оксидах, нанесенных на Si02, авторы [79] пришли к выводу о последовательном, чисто гетерогенном механизме:
Активность определяется скоростью стадии (1), а селективность образования формальдегида — соотношением скоростей стадий (2) и (3). Для катионов с большой электроотрицательностью X, т. е. для оснбвных оксидов, большой заряд на кислороде 0^~ оксида способствует отщеплению Н от метана. Для катионов с малой X или для кислотных оксидов Р205, В203, М0О3, V205 малый заряд на 0*" облегчает его присоединение к СНЖ и образование СН20.
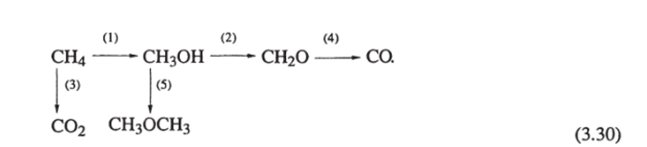
На МоОз/БЮг изучена кинетика окисления СН4, СН3ОН и СН20 при 370−650°С [72]. Предложен параллельно-последовательный гетерогенный механизм:
Были рассчитаны константы скорости первого порядка для каждой реакции и соответствующие энергии активации: Е = 189 кДж/моль, ?2 = 134 кДж/моль и ?3 = 189 кДж/моль. По этим и последующим [81] данным в работе [85] построена более развернутая параллельно-последовательная схема окисления метана на MoOi/SiO? и V?0 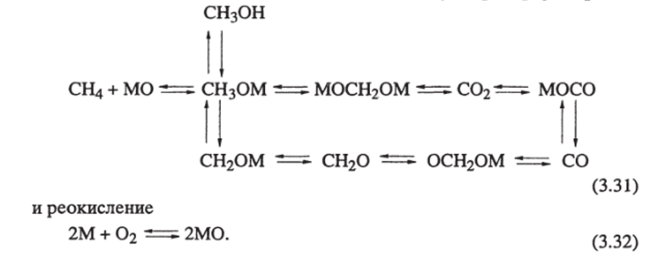
Используя данные о константах взаимодействия стадий схемы (3.31) из различных источников, авторы [85] построили макрокинетическую модель, в общем удовлетворительно согласующуюся с экспериментом [72, 81]. Предельные выходы формальдегида объясняются здесь тем, что он является промежуточным продуктом в окислении СО. С02 образуется двумя путями: прямо из метана и через промежуточное образование СО в газовой фазе. В первом случае выход С02 не зависит от степени конверсии СН4 (М0О3), во втором случае он растет с ростом степени конверсии (V205).