Влияние давления и инертных газов

Реакция (7.23), приводящая к образованию конечного продукта — этана протекает с участием «третьего тела» М. Третьим телом может быть как поверхность катализатора в порах, так и молекулы в газовой фазе. Отсюда следует ожидать влияния давления на скорость рекомбинации СН3 -радикалов и повышения С2-селективности. В работах М. Ю. Синева и соавт. эта проблема исследована на катализаторе Nd203/Mg0… Читать ещё >
Влияние давления и инертных газов (реферат, курсовая, диплом, контрольная)
В соответствии со схемой (7.29) и уравнением (7.33) при росте давления О2 селективность образования С2-углеводородов должна уменьшаться, давление же метана не должно оказывать существенного влияния. Однако формула (7.33) верна лишь при малых конверсиях. При высоких давлениях и высоких конверсиях соотношение между гетерогенными и гомогенными процессами может измениться в пользу последних. При этом может возрасти роль нежелательных реакций, ведущих к глубокому окислению. Уменьшение селективности с ростом Pq2, действительно, наблюдалось многими исследователями [74, 96,.
132, 142,272].
Ю.П. Тюленин и соавт. [379, 380] изучили влияние давления на окислительную конденсацию метана на Li/MgO. Чтобы уменьшить роль газофазных реакций, пространство за реактором заполнялось неактивным MgO. В этих условиях при повышении давления от 100 до 800 кПа конверсия СН4 возросла от 28,1 до 34,1%, селективность образования С2Н6 упала с 20,6 до 10,1%, а образование С2Н4 выросло с 20,5 до 26,5%, отношение С2Н4/С2Н6 увеличилось от 1,0 до 2,62, выход СО несколько возрос, а выход С02 упал. Таким образом, главный эффект давления заключается в увеличении выхода С2Н4 за счет С2Н$ и выхода СО за счет С02. Последнее происходит за счет уменьшения роли гетерогенных реакций глубокого окисления. Как отмечается авторами [381], исследовавшими окислительную конденсацию метана на Li/MgO, при 850 °C этан образуется из этилена в основном в посткаталитическом объеме.
Рост селективности образования С2Н4 и некоторое уменьшение общей селективности по С2-углеводородов отмечалось и в работах других авторов [382−384]. Выход С2Н4 возрастает даже выше, чем это соответствует равновесиям С2Н6 ^ С2Н4 + Н2 и С2Нб + V2O25 C2Ht + + Н20, более важны здесь кинетические факторы. Отсюда следует, что окислительное дегидрирование этана протекает в значительной мере в газовой фазе.
Реакция (7.23), приводящая к образованию конечного продукта — этана протекает с участием «третьего тела» М. Третьим телом может быть как поверхность катализатора в порах, так и молекулы в газовой фазе. Отсюда следует ожидать влияния давления на скорость рекомбинации СН3 -радикалов и повышения С2-селективности. В работах М. Ю. Синева и соавт. [385, 386] эта проблема исследована на катализаторе Nd203/Mg0 путем изменения давления и добавок инертных газов. К смеси СН4: 02 = 9:1(1 атм) добавлялись инертные газы при разных давлениях. Результаты показаны на рис. 7.23 и 7.24 [385].
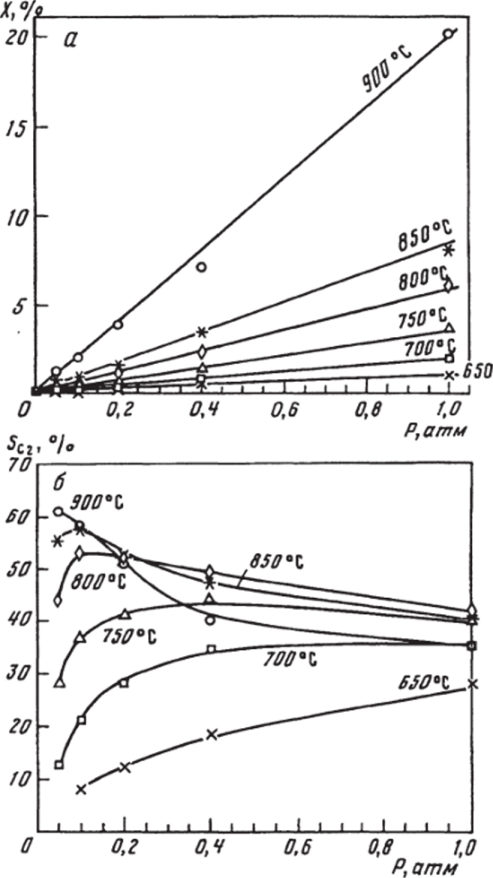
Рис. 7.23. Зависимость конверсии метана (л) и С2-селективности (б) от общего давления (СН4 : ()2 = 9: 1) на катализаторе 1% NdjC^/MgO при различных температурах.
На рис. 7.23 показаны изменения конверсии СН4 и С2-селективности в зависимости от давления смеси на Nd203/Mg0 при разных температурах. Конверсия метана растет с ростом давления (см. рис. 7.23, а). Селективность изменяется более сложным образом (см. рис. 7.23, б): при 650−700°С она растет с ростом давления, при 750−850°С проходит через максимум, а при 900 °C уменьшается.
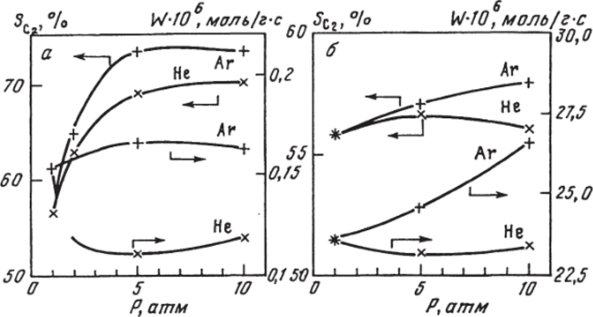
Рис. 7.24. Зависимость С2-селективности и скорости конверсии (W) СН4 от общего давления при 750 °C, P^H4 +^Ь2 = * а™ и ПРИ Д°^авк€ инертных газов Не и Аг.
а — без катализатора при 800 °C; б — на катализаторе 1% Nd203/MgO.
В пустом реакторе (см. рис. 7.24, а) изменение конверсии метана при добавлении инертного газа обычно невелико: в разных случаях, для разных времен контакта и разных газов скорость может возрастать, падать, проходить через максимум или через минимум, но изменения не превышают 40%. Селективность же в (^-углеводороды быстро растет с ростом давления, для Аг быстрее, чем для Не, и выше 5 атм приходит к пределу.
В присутствии катализатора 1% Nd203/MgO (рис. 7.24, б) кривые изменения конверсии и селективности с ростом давления инертного газа в общем похожи на кривые для пустого реактора (рис. 7.24, а), но эффект значительно слабее, для гелия он почти не проявляется. Влияние инертных газов более заметно при низких температурах и для более активного катализатора 10% Nd203/Mg0, работающего при 550−625°С, влияние гелия и аргона сильнее, чем для 1% Nd2C>3/MgC).
Авторы [385] анализируют полученные результаты с точки зрения рассмотренной в разделе 7.4.3 схеме (7.29). Если переписать уравнение (7.23) для максимальной (^-селективности в форме:

где: к2 — константа скорости реакции рекомбинации (7.23), К — константа равновесия реакции (7.22), а X — сумма констант реакций, ведущих к глубокому окислению, можно применить для расчета к2 схему бимолекулярных газовых реакций Линдемана:

где к к" и к— константы скорости образования, разложения и релаксации возбужденной молекулы этана в присутствии молекулы М.
Эксперимент находится в соответствии с формулой (7.69): рост общего давления в отсутствие катализатора увеличивает скорость рекомбинации вплоть до предела при к2 = к' соответственно изменяется и С2-селективность. Катализатор, с одной стороны, увеличивает скорость генерации радикалов СН3, с другой — может действовать как третье тело М, участвующее в рекомбинации и образовании этана. Этим, возможно, и объясняются разные зависимости селективности от давления на рис. 7.23, а. Частота столкновений молекулы С2Н^ с катализатором сравнима с частотой столкновений с молекулами М в газовой фазе. Из-за этого гелий не влияет, а аргон мало влияет на селективность в присутствии катализатора.
Большее влияние давления инертных газов на активность и селективность действия активного катализатора 10% Nd/MgO было объяснено его пористой и высокоразвитой поверхностью (15 м2/г в сравнении с 0,5 м2/г для 1% Nd/MgO). В пористом катализаторе диффузионные затруднения возрастают пропорционально Рч4м, где М — средняя молекулярная масса газовой смеси. Это может вести к добавочной конверсии реагентов при увеличении давления и к «диффузионному» ускорению суммарного процесса [386].