Кислоты.
Общая и неорганическая химия для фармацевтов

Названия кислородсодержащих кислот образуются от названия элемента с добавлением суффиксов «-н», «-ов» или «-ев», если элемент имеет высшую степень окисления: H2S04 — серная кислота, Н2Сг04 — хромовая кислота, НМп04 — марганцевая кислота. По мере понижения степени окисления центрального атома меняется суффикс в названии: «-оват», «-ист», «-оватист», например, НСЮ4 — хлорная, НСЮ3 — хлорноватая… Читать ещё >
Кислоты. Общая и неорганическая химия для фармацевтов (реферат, курсовая, диплом, контрольная)
По составу кислоты подразделяют на бескислородные (НО, H2S и др.), являющиеся растворами в воде водородных соединений неметаллов, и кислородсодержащие (H2S04, HN03) — гидроксиды кислотных оксидов.
По числу атомов водорода, способных замещаться на металл, кислоты делят на одноосновные (НС1), двухосновные (H2S04), трехосновные (Н3РО4) и т. д.
По способности диссоциировать в водном растворе кислоты делят на сильные, которые диссоциируют практически полностью, и слабые, которые диссоциируют в малой степени.
Существует правило, согласно которому силу кислородсодержащей кислоты часто можно качественно оценить, представив ее в виде ЭОш(ОН)м. При значениях т больше или равных двум — кислота сильная.
Иногда отдельно выделяют кислоты-окислители: HN03, H2S04/KOllU4 и кислоты-восстановители: HI, H2S, в которых окислителем или восстановителем является кислотообразующий элемент.
Названия бескислородных кислот составляют из названия элемента, образующего кислоту, с добавлением суффикса «-о» и слова «водородная»: HF — фтороводородная кислота, H2S — сероводородная кислота.
Названия кислородсодержащих кислот образуются от названия элемента с добавлением суффиксов «-н», «-ов» или «-ев», если элемент имеет высшую степень окисления: H2S04 — серная кислота, Н2Сг04 — хромовая кислота, НМп04 — марганцевая кислота. По мере понижения степени окисления центрального атома меняется суффикс в названии: «-оват», «-ист», «-оватист», например, НСЮ4 — хлорная, НСЮ3 — хлорноватая, НСЮ2 — хлористая, НСЮ — хлорноватистая кислота. Нетрудно заметить, что с понижением степени окисления элемента сила кислоты убывает.
Названия кислот, содержащих в своем составе разное число молекул воды, приходящихся на одну молекулу оксида, получают добавлением приставок «мета-» (меньшее) или «орто-» (большее), а являющихся димерами, Некоторые кислоты, кислотные остатки и их названия.
Кислота. | Кислотный остаток (анион). | ||
HF. | Фтороводородная (плавиковая). | F. | Фторид. |
HCI. | Хлороводородная (соляная). | Cl. | Хлорид. |
НВг. | Бромоводородная. | Вг. | Бромид. |
HI. | Иодо водородн ая. | I. | Йодид. |
IICN. | Циановодородпая (синильная). | CN. | Цианид. |
HN03 | Азотная. | N03 | Нитрат. |
hno2 | Азотистая. | О к; |. | Нитрит. |
нсю4 | Хлорная. | сю4 | Перхлорат. |
HMn04 | Марганцевая. | Мп04 | Перманганат. |
H2Si03 | Кремниевая. | SiO|. | Силикат. |
H2so4 | Серная. | hso4 | Гидросульфат. |
sof. | Сульфат. | ||
H2so3 | Сернистая. | hso3 | Гидросульфит. |
so32; | Сульфит. | ||
H2S. | Сероводородная. | IIS. | Гидросульфид. |
s2^. | Сульфид. | ||
H2C03 | Угольная. | HC03 | Гидрокарбонат. |
CO2 | Карбонат. | ||
H2Cr ()4 | Хромовая. | CrO|. | Хромат. |
H2Cr207 | Дихромовая. | Cr207~. | Дихромат. |
H3P04 | Ортофосфорная (фосфорная). | ii2po4 | Дигидрофосфат. |
iipo42 | Гидрофосфат. | ||
T5. I. | Фосфат. | ||
т.е. образованных двумя спаренными молекулами кислоты, — приставку «пиро-». Например, НР03 — метафосфорная, Н3Р04 — ортофосфорная, Н4Р207 — пирофосфорная (дифосфориая) кислота.
Для получения кислот могут быть использованы следующие реакции.
1. Бескислородные кислоты могут быть получены реакцией простых веществ с водородом с последующим растворением продукта в воде:

2. Кислородсодержащие кислоты получают взаимодействием кислотного оксида с водой:

3. Вытеснением из солей более сильной или менее летучей кислотой получают более слабые или более летучие кислоты: 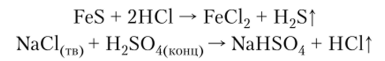
4. Некоторые кислоты получают в результате обменных реакций в растворе, приводящих к выпадению осадка:

5. Ряд кислот (H2S04, Н3Р04) можно получить окислением простых веществ кислотами-окислителями:
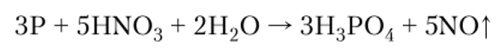
Рассмотрим химические свойства кислот.
- 1. Наличие ионов водорода в растворах кислот обусловливает их кислый вкус и изменение окраски индикаторов: лакмус краснеет, метиловый оранжевый становится розовым.
- 2. Кислоты взаимодействуют с основными и амфотерными оксидами с образованием солей:
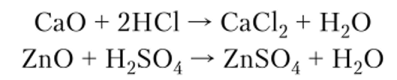
3. С основаниями и амфотерными гидроксидами кислоты реагируют с образованием солей (при недостатке кислоты могут образовываться основные соли, а при избытке кислоты — кислые соли):
НС1 + NaOH —? NaCl + Н20 — образование средних солей.
3H2S04 + 2А1(ОН)3 — A12(S04)3 + 6Н20.
НС1 + Са (ОН)2/избч —5? Са (ОН)С1 + Н20 — образование основной соли.
H2S03(it36) + NaOH —* NaHS03 + Н20 — образование кислой соли.
4. Кислоты могут реагировать с солями при условии, что при этом образуется более слабая кислота, выделяется газообразное вещество или выпадает осадок:
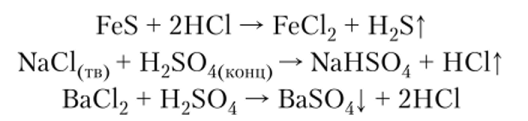
При взаимодействии кислот с основными солями образуются средние соли, а при взаимодействии со средними солями многоосновных кислот могут образовываться кислые соли:
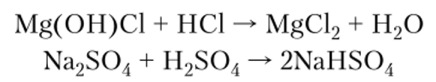
5. Растворы кислот реагируют, выделяя водород, с металлами, восстановительный потенциал которых ниже восстановительного потенциала ионов водорода: 
В ряде случаев характер такого взаимодействия зависит от природы кислоты и ее концентрации. Например, из азотной кислоты любой концентрации, а также из концентрированной серной кислоты ни один металл не вытесняет водород, так как окислителями в них являются атомы азота и серы соответственно. При этом некоторые металлы (Al, Fe) покрываются плотной защитной пленкой соответствующего оксида (пассивируются), предохраняющего их от дальнейшей реакции. (Более подробно об этом говорится далее в свойствах азотной и серной кислот.).
6. Кислоты-окислители могут взаимодействовать с некоторыми металлами, стоящими в ряду активности после водорода, и с некоторыми неметаллами:
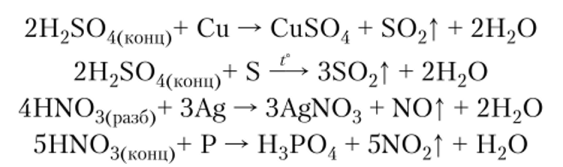
7. Некоторые кислоты неустойчивы и разлагаются либо при попытке выделения, либо при нагревании, либо при длительном стоянии на свету:

8. С водой некоторые кислоты образуют гидраты, например
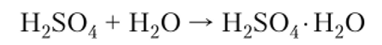
9. Многие кислоты реагируют со спиртами (при реакции галогеноводородных кислот образуются галогенопроизводные, из кислородсодержащих кислот — сложные эфиры):
С2Н5ОН + НВг — С2Н5Вг + н2о С2Н5ОН + H2S04 ^ c2h5oso3h + н2о.