Элементы /-блока.
Общая и неорганическая химия для фармацевтов

Соли РЗЭ и сильных кислот (сульфаты, нитраты, хлориды, перхлораты) хорошо растворимы в воде. Их водные растворы лишь в незначительной степени гидролизованы, причем степень гидролиза возрастает с уменьшением радиуса металла. Соли слабых кислот (нитриты, сульфиды, цианиды) из водных растворов выделить не удается ввиду их полного гидролиза. Карбонаты, фосфаты и фториды РЗЭ практически не растворимы… Читать ещё >
Элементы /-блока. Общая и неорганическая химия для фармацевтов (реферат, курсовая, диплом, контрольная)
Элемент лантан генетически связан с 4/-элементами, следующими за ним и называемыми лантаноидами. Тяготеет к лантаноидам и иттрий. Все эти 16 элементов в природе встречаются в одних и тех же минералах, и их принято объединять в одну группу редкоземельных элементов (РЗЭ). Скандий, благодаря малому радиусу, отличается от РЗЭ, и его химические свойства обычно рассматриваются отдельно.
При движении по группе сверху вниз атомный и ионный радиус элементов последовательно увеличивается, но при рассмотрении ряда-элементов наблюдается монотонное уменьшение радиусов атомов, что объясняется кулоновским сжатием оболочки из-за увеличения заряда ядра и числа электронов. Это явление получило название лантаноидного сжатия.
Элементы IIIВ, кроме актиния, характеризуются сравнительно высоким содержанием в земной коре, но они рассеяны и собственные минералы образуют редко. Главные минералы лантаноидов: монацит (Y, La, Ln, Th) P04 и бастнезит (Y, La, Ln) C03F. Каждый из них содержит сразу все или почти все РЗЭ.
При разделении редкоземельных элементов было замечено, что, но свойствам легкие лантаноиды близки к лантану, тяжелые — к иттрию. На основании этого первые шесть лантаноидов (Се —Ей) и сам лантан относят к цериевой подгруппе, а иттрий и более тяжелые лантаноиды (Gd — Lu) — к иттриевой подгруппе. Монацит — основное сырье для производства РЗЭ цериевой подгруппы. Источником элементов иттриевой подгруппы служит близкий по составу минерал ксенотим.
Редкоземельные металлы — тугоплавкие вещества серебристо-белого цвета, празеодим и неодим имеют желтоватый оттенок. Для всех РЗЭ характерен полиморфизм.
Для всех РЗЭ наиболее устойчива степень окисления (+3). У лантаноидов она реализуется переходом одного /-электрона на ^/-орбиталь с последующей потерей трех 5б/1б52-электронов. Поведение /-элементов несколько неожиданно. Число /-электронов растет, а степень окисления не изменяется. Это объясняется тем, что более двух /-электронов не участвуют в образовании связей, причиной чему является сложная форма /-орбиталей. Они не гибридизуются с 5- и р-орбиталями, поэтому лантаноиды преимущественно образуют ионные связи.
В металлическом состоянии лантан и другие металлы получают в результате восстановления хлоридов или фторидов металлическим кальцием:

В форме простых веществ РЗЭ легко вступают в химические реакции. При повышенной температуре они легко окисляются, образуя оксиды:
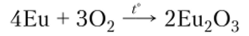
Для церия более устойчив диоксид Се02. Оксиды РЗЭ во многом напоминают оксид магния.
При сплавлении с серой РЗЭ образуют сульфиды Ln2S3, а при взаимодействии с галогенами — тригалогениды LnX3. Среди галогенидов наибольшее значение имеют трифториды и трихлориды — гигроскопичные вещества, подобные галогенидам алюминия, но в отличие от них не подвергающиеся значительному гидролизу.
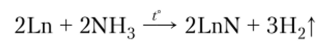
Реакция редкоземельных элементов с водородом протекает с выделением теплоты, но для ее начала необходимо нагревание. При этом, как правило, образуются гидриды нестехиометрического состава. Нитриды лантаноидов получают при взаимодействии металлов с аммиаком, а фосфиды LnP и карбиды Ln2C3 — непосредственно из простых веществ:
При повышении степени окисления от (+3) до (+4) основные свойства оксидов сменяются амфотерными. Соединения церия (1У) сходны с соединениями 3<7-элементов по окислительной способности и кислотно-основным свойствам.
Се02 — бледно-желтый порошок, нерастворимый в воде и растворах кислот. При нагревании с избытком концентрированной серной кислоты его можно перевести в сульфат:
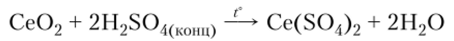
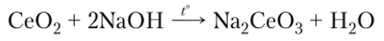
При сплавлении Се02 со щелочами или оксидами щелочных металлов образуются цераты:
Под действием различных окислителей соединения церия (Ш) легко переходят в соединения церия (1У), что находит применение в количественном анализе. Так, при окислении гидроксида церия (Ш) пероксидом водорода образуется красновато-бурый осадок нероксосоединения. Эта реакция используется для качественного определения ионов церия:
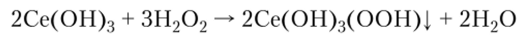
РЗЭ образуют комплексные соединения с различными лигандами, в которых проявляют необычно большие координационные числа от 7 до 12:
[Ndl9]6, [Gd (Br03)9]6. Высокие и переменные координационные числа вызваны ионным характером связей.
Соли РЗЭ и сильных кислот (сульфаты, нитраты, хлориды, перхлораты) хорошо растворимы в воде. Их водные растворы лишь в незначительной степени гидролизованы, причем степень гидролиза возрастает с уменьшением радиуса металла. Соли слабых кислот (нитриты, сульфиды, цианиды) из водных растворов выделить не удается ввиду их полного гидролиза. Карбонаты, фосфаты и фториды РЗЭ практически не растворимы.
Гидроксиды РЗЭ выпадают в виде студенистых осадков Ln (OH)3 при действии на растворы солей аммиаком, аминами или растворами щелочей. По своим свойствам они сходны с гидроксидом магния. Основность гидроксидов незначительно уменьшается с уменьшением радиуса атома элемента.
Скандий — типичный рассеянный элемент. Выделяют скандий из отходов производства титана, циркония, вольфрама. Это легкий серебристый металл с желтым отливом, мягкий и легко поддающийся обработке. Химические свойства скандия (Ш) во многом напоминают химические свойства алюминия.