Трансляция белка.
Концепции современного естествознания

Третья стадия элонгации состоит в том, что рибосома сдвигает мРНК на один триплет (она приближает к себе З'-конец). Указанная стадия называется транслокацией. Она также происходит под воздействием белковых факторов и ГТФ. В результате транслокации пептил-тРНК оказывается на P-участке. Ранее находившаяся в ней свободная тРНК вытесняется из нее (она выполнила свои функции, ей больше нечего делать… Читать ещё >
Трансляция белка. Концепции современного естествознания (реферат, курсовая, диплом, контрольная)
Материал двух предыдущих параграфов позволяет перейти к рассмотрению механизма синтеза белка, который совершается в рибосомах, органоидах, состоящих из двух субъединиц, большой и малой. Матрицей биосинтеза (трансляции) является мРНК. Трансфер аминокислот, необходимых для биосинтеза, осуществляют тРНК. Многоступенчатый синтез белка реализует соответствующая система, компоненты которой указаны в табл. 6.7.
Таблица 6.7
Основные компоненты белоксинтезирующей системы.
Компоненты. | Функции. |
Рибосомы. | Направляют ход процесса синтеза. |
Аминокислоты. | Формируют субстрат белка. |
Матричная РНК. | Является матрицей синтеза и задает последовательность кодонов, определяющих первичную структуру белка. |
Транспортные РНК. | Осуществляют прием аминокислот, их трансфер и присоединение к соответствующему кодону мРНК. |
Рибосомные РНК. | Соединяют в единую цепь аминокислоты. |
Аминоацил-тР11К-синтетазы. | Присоединяют к каждой т-РНК одну аминокислоту. |
Аденозинтрифосфат (АТФ) Гуанозинтрифосфат (ГТФ). | Источники энергии. |
Белковые факторы. | Регулируют ход инициации, элонгации, терминации и трансляции. |
Исключительно актуальную роль играют в процессе синтеза тРНК. Транскрипция, рассмотренная в параграфе 6.6, приводит к образованию незрелой тРНК (пре-тРНК), она, по определению, обладает первичной структурой. Посредством процессинга пре-тРНК трансформируется в зрелую тРНК. Процессинг включает много стадий, в эукариотах это, в частности, добавление последовательности ССА на З'-конец, вырезание нитронов (сплайсинг), модификация отдельных нуклеотидов (всего их в молекуле тРНК от 73 до 95). Зрелая тРНК транспортируется в цитоплазму клетки, где она начинает принимать участие в синтезе белка (сначала вне рибосомы). На рис. 6.11 изображена вторичная структура молекулы тРНК, состоящая из 76 нуклеотидов.
Каждая часть молекулы т-РНК обладает специфическими функциями. Акцепторный стебель заканчивается триплетом АС С, именно к нему присоединяется аминокислота. D-петля распознается аминоациол-тРНКсинтетазой. Г-петля распознается рРНК. А антикодон, нуклеотиды 34—36, присоединяется к кодону м-РНК. Функции дополнительной петли не выяснены. Высказываются предположения, что она дополняет функции Г- и D-петель и вместе с ними определяет устойчивость пространственной структуры всей молекулы.
Условием биосинтеза белка является прикрепление к тРПК именно той аминокислоты, которая соответствует антикодону. Для каждой из 20 аминокислот существует своя аминоацил-тРНК-синтетаза. Она обеспечивает следующую реакцию: 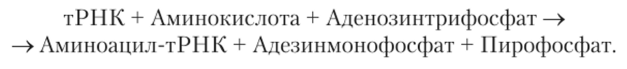 [1]
[1]
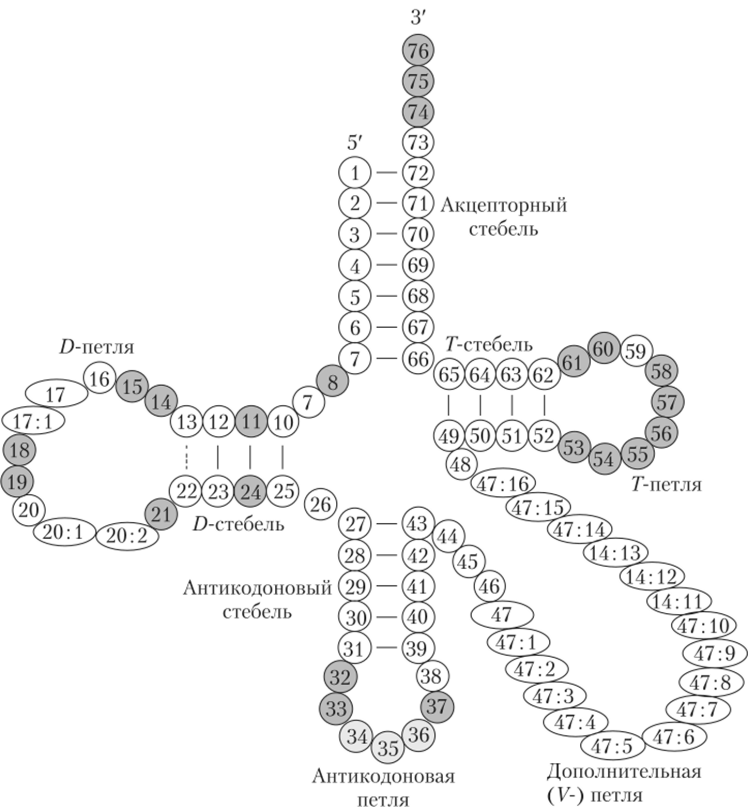
Рис. 6.11. Вторичная структура т-РНК1
Аминоацил-тРНК — это тРНК с прикрепленной к ней аминокислотой, дальнейшая судьба которого связна с инициацией, элонгацией и терминацией синтеза белка на рибосоме.
Инициация проходит в эукариотах и прокариотах по-разному. Но, в конечном счете, в обоих случаях получается сходный результат. Состоит же он в том, что, во-первых, малая субъединица рибособы присоединяется к AUG- кодону мРНК, который кодирует метонин. Во-вторых, сюда же привлекается инициативная аминоацил-тРНК. В-третьих, к малой субъединице присоединяется большая субъединица. После этого наступает этап элонгации.
На рис. 6.12. изображены две субъединицы рибосомы, большая и малая, обхватывающие мРНК, состоящей из триплетных кодонов, которые распознаются антикодонами амионоацил-тРНК (на рисунке они представлены трезубцами). Аминокислоты в составе аминоацил-тРНК изображены в виде кружочков. Рибосома формирует два участка А и Р. Участок А предназначен для приема аминоацил-тРНК. На участке Р происходит заключительная фаза образования пептидной группы, состоящей из нескольких аминокислот.
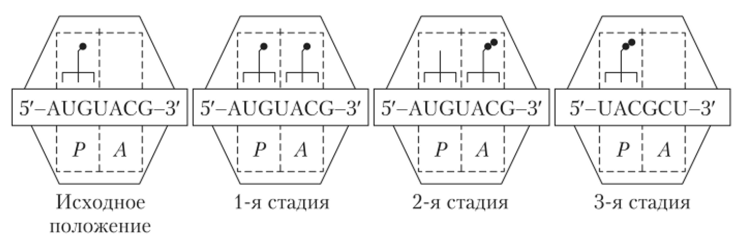
Рис. 6.12. Элонгационный цикл синтеза белка
В исходном положении, наступившем после инициации трансляции, на P-участке находится метонин-тРНК. Метонин кодируется триплетом AUG, он находится на «хвосте» тРНК. Соседний A-участок пуст, но он в известной степени активирован. Это означает, что из всех аминоацилтРНК преференцию имеет та, которая содержит аминокислоту, соответствующую, согласно избранному примеру, кодону UAC. В нашем случае это тирозин-тРПК. Именно эта аминоацил-тРНК притягивается к UAC-кодону. Общее число кодонов и, соответственно, антикодонов, одинаково, а именно равно 64. Три из них кодируют остановку трансляции. Это означат, что общее число аминоацил-тРНК равно 61 (64 — 3). Число же тРНК, необходимое для обеспечения функционирования аминоацил-тРНК, меньше 61 и составляет от 41 до 50. Дело в том, что аминоацил-тРНК может переносить несколько аминокислот, а именно таких, кодоны которых отличаются лишь третьим основанием триплета.
Первая стадия элонгации состоит в том, что к P-участку присоединяется новая аминоацил-тРНК, которая, как уже было отмечено, является тирозин-тРНК. Рассматриваемая связь совершается под влиянием белковых факторов и гуазинтрифосфата (ГТФ).
Вторая стадия элонгации состоит в том, что аминоацил-тРНК превращается в пеитидил-тРНК (трезубец с двумя кружками). Это означает, что к аминокислоте, находящейся на Л-участке, присоединяется аминокислотный состав того образования, который находится в P-зоне. Пептизация происходит также на Л-участке, причем для ее осуществления не требуется привлечение дополнительных энергетических факторов. На Р-участке остается свободная, т. е. не нагруженная аминокислотой, т-РНК.
Третья стадия элонгации состоит в том, что рибосома сдвигает мРНК на один триплет (она приближает к себе З'-конец). Указанная стадия называется транслокацией. Она также происходит под воздействием белковых факторов и ГТФ. В результате транслокации пептил-тРНК оказывается на P-участке. Ранее находившаяся в ней свободная тРНК вытесняется из нее (она выполнила свои функции, ей больше нечего делать на P-участке). Она возвращается в цитоплазму. Что касается Л-участка, то он готов к приему новой аминоацил-тРНК. Применительно к тому случаю, который изображен на рис. 6.12, это аланин, ибо GCU является именно его кодоном. Итак, первый цикл элонгации закончился. Все последующие циклы элонгации будут реализовываться в три стадии: 1) связывание аминоацил-тРНК с Л-участком, 2) ее превращение в пептидил-гРНК и 3) перемещение на P-участок (транслокация).
Окончание элонгации (терминация) наступает после того, как в Л-участок попадает один из трех стоп-кодонов UAA, UAG> UGA. Это событие сопровождается действием белковых и ГТФ-факторов, последствием которого является диссоциация рибосомы на ее субчастицы, и высвобождением всех других участников процесса биосинтеза белка. Первичная структура белка в форме полипептидной цепи образуется в рибосоме. Под воздействием белковых факторов она в дальнейшем модернизируется в цитоплазме.
Выводы.
- • Поли пептидная цепь белка образуется в рибосомах посредством процесса трансляции кода мРНК.
- • В этом процессе исключительно актуальную роль играет транспортные РНК, каждая из частей которых, а именно антикодон, акцепторный стебель, D- и Г-ветви, выполняют специфические функции.
- • Инициация трансляции выступает как образование рибосомы из двух ее субъединиц и связывания метонин-тРНК со стартовым кодоном AUG.
- • Элонгация реализуется посредством: 1) связывания аминоацил-тРНК с Л-участком рибосомы; 2) превращения аминоацил-тРНК в псптидил-тРНК; 3) транслокации.
- • Терминация инициируется попаданием на Л-участок одного из стоп-кодонов.
- • Первичная структура белков модернизируется в цитоплазме.
- [1] Фаворова О. О. Транспортные РНК на первом (предрибосомном) этапе биосинтеза белков // Современное естествознание: энциклопедия: в 10 т. Т. 8. Молекулярные основы биологических процессов. М.: Издательской Дом МАГИСТР-ПРЕСС, 2000. С. 90.