Понятие о методе молекулярных орбиталей

Атом гелия отличается от атома водорода тем, что у него имеется два электрона (152). Следовательно, в гипотетической молекуле Не2 должно быть четыре электрона, из которых одна пара должна занять связующую МО, а другая — разрыхляющую МО. Стабилизация, обусловленная парой электронов на связующей МО, компенсируется антисвязывающим влиянием электронов на разрыхляющей МО, вследствие чего два атома… Читать ещё >
Понятие о методе молекулярных орбиталей (реферат, курсовая, диплом, контрольная)
Метод валентных связей в своей простейшей форме дает не совсем удовлетворительное описание химической связи, поскольку трудно перенести его на неэмпирический уровень для всех молекул, за исключением простейших.
Более универсальным квантово-механическим методом описания химической связи является метод молекулярных орбиталей (ММО).
Метод молекулярных орбиталей представляет собой квантово-химическое описание химической связи и рассматривает молекулу как «многоядерный атом», в котором электроны заселяются по молекулярным орбиталям. В этом случае атомные и молекулярные орбитали представляют собой одноэлектронные волновые функции соответственно атома или молекулы с той лишь разницей, что АО — одноцентровые, а МО — многоцентровые. Молекулярные орбитали строятся как линейные комбинации атомных орбиталей (ЛКАО).
Для образования молекулярных орбиталей необходимо, чтобы: 1) атомные орбитали имели примерно равные энергии; 2) заметно перекрывались; 3) обладали одинаковой симметрией относительно образуемой химической связи.
С точки зрения используемой терминологии метод валентных схем можно рассматривать как частный вариант метода молекулярных орбиталей, где используются только двухцентровые МО.
Рассмотрим связь в молекуле Н2 по ММО. При сближении атомов Нл и Н1} вместо первоначальных атомных орбиталей, центрированных по одной на каждом атоме, возникает молекулярная орбиталь, охватывающая оба атома (рис. 4.22). Когда один электрон находится вблизи ядра атома Нл, то принято считать, что молекулярная орбиталь очень близка к атомной, обозначаемой как фл. Аналогично если электрон находится вблизи ядра Нй, то молекулярная орбиталь соответственно сходна с iB. Так как МО попеременно характеризуется функциями ц/л и ув, то ее можно представить в виде суммы:

Уравнение (4.8) показывает, что сложение двух атомных орбиталей с образованием одной молекулярной говорит о том, что два электрона в молекуле Н2 взаимодействуют с обоими ядрами, находясь преимущественно.
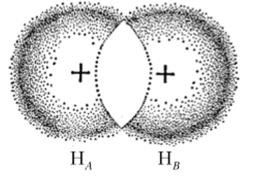
Рис. 4.22. Перекрывание 15-орбиталей двух атомов водорода.
между ними и связывая их. Следовательно, функция (рсв называется связывающей орбиталью. На рис. 4.23, а показан процесс сложения двух АО. Знак «плюс» на МО указывает на то, что волновая функция везде положительна. Образовавшаяся молекулярная орбиталь имеет цилиндрическую симметрию и называется ст-орбиталыо.
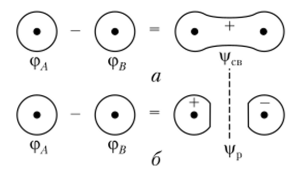
Рис. 4.23. Сложение (а) и вычитание (б) двух атомных 15-орбиталей с образованием связующей и разрыхляющей молекулярных орбиталей Поскольку из двух АО возможно образование двух МО, то помимо функции, представленной в виде суммы (уравнение (4.8)), возможна и вторая функция в виде разности атомных орбиталей:

Такая молекулярная орбиталь имеет противоположные знаки (рис. 4.23, б) у разных ядер, следовательно, вероятность нахождения электронов между ядрами равна нулю. Эта орбиталь не способствует образованию химической связи, так как ядра из-за отсутствия электронов между ними отталкиваются. Такая орбиталь называется разрыхляющей орбиталью и обозначается а* (рис. 4.24).
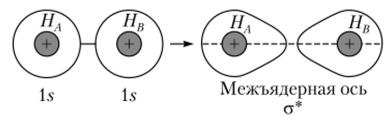
Рис. 4.24. Образование разрыхляющей молекулярной орбитали.
Молекулярные орбитали, так же как и атомные, подчиняются принципу Паули, т. е. на каждой из них может находиться не более двух электронов, и только тогда, когда эти два электрона имеют противоположные спины.
Если известны знак и величина перекрывания между конкретной парой атомных орбиталей, то образование молекулярной орбитали можно изобразить в виде энергетической диаграммы (рис. 4.25).
Распределение электронов по МО позволяет объяснить многие свойства молекул. Вместо понятия «ковалентность» ММО вводит понятие «порядок связи», которое определяется как частное от деления разности между.
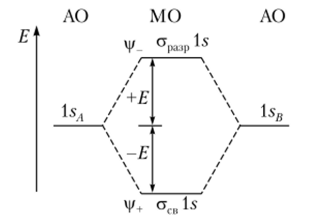
Рис. 4.25. Энергетическая диаграмма уровней атомных и молекулярных.
орбиталей водорода количеством электронов на связывающей МО и на разрыхляющей МО на число взаимодействующих атомов. Порядок связи (или кратность связи) может принимать как целочисленные, так и дробные значения, но всегда с положительным знаком.
Из этого следует, что для образования связи между атомами необходимо, чтобы на связующей МО заселенность электронами всегда была больше, чем на разрыхляющей МО. Только в этом случае система энергетически выгодна и стабильна. Если порядок связи равен нулю, то связь не образуется. В молекуле Н2 порядок связи равен единице, вН2+— 0,5, а в системе из двух атомов Не — нулю.
Метод молекулярных орбиталей позволяет правильно объяснить строение гомои гетероядерных молекул.
Двухатомные гомоядерные молекулы. Элементы первого периода — водород и гелий — характеризуются тем, что валентной является 15-орбиталь. Приведенная на рис. 4.25 энергетическая диаграмма МО справедлива для систем Н2, Н2, Не2 и Не2. В молекуле Н2 имеется два электрона, которые согласно принципу наименьшей энергии и запрету Паули заселяют асв 15-орбиталь. Процесс формирования молекулы Н2 можно представить так:
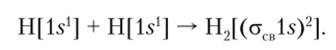
Поскольку у каждого из атомов имеется по одному электрону, то их спины спариваются и образовавшаяся пара заполняет связующую МО, благодаря чему образуется связь.
Атом гелия отличается от атома водорода тем, что у него имеется два электрона (152). Следовательно, в гипотетической молекуле Не2 должно быть четыре электрона, из которых одна пара должна занять связующую МО, а другая — разрыхляющую МО. Стабилизация, обусловленная парой электронов на связующей МО, компенсируется антисвязывающим влиянием электронов на разрыхляющей МО, вследствие чего два атома гелия не могут соединиться друг с другом. Образование молекулы Не2 исключено, так как два изолированных атома гелия более устойчивы.
Молекулярный ион Н2 состоит из двух протонов и одного электрона, который занимает энергетически наиболее выгодную асв15-орбиталь.
В Не2 имеется три электрона, из которых два заселяют связывающую МО, а третий — разрыхляющую МО. Это и определяет стабильное существование этой системы.
У элементов второго периода кроме ls-орбиталей имеются 2sи 2р- (2р-, 2р- и 2рг-)орбитали, которые принимают участие в образовании молекулярных орбиталей. Если для 2s- и 2р-орбиталей различие, но энергии незначительно, то при построении молекулярной ст-орбитали их необходимо учитывать. При этом возникнут МО, нс имеющие «чистого» s- или р-характера. Если же для 2s- и 2р-орбиталей различие по энергии значительно, то перекрывание, но типу s —pB или sB—pA не осуществляется. При комбинации 2. у-орбиталей должны образоваться две молекулярные ст-орбитали: одна связующая ст1В2.у-орбиталь и одна разрыхляющая страф2.у-орбиталь. Если взаимодействуют 2р-орби гали, то характер перекрывания 2рг-орбиталей отличается от таковых 2р — и 2рг-орбиталей. Атомные 2р(-орбитали вытянуты вдоль оси х, поэтому при их комбинации образуются молекулярные ст-орбитали: стсв2рх и ст|Ш])2рх (рис. 4.26).
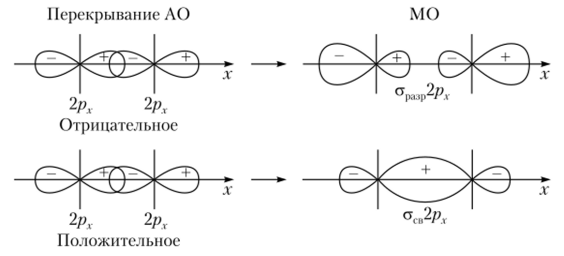
Рис. 4.26. Схема образования связывающей и разрыхляющей молекулярных.
стд-орбиталей Взаимодействие же 2/?г-орбиталей дает две молекулярные л-орбитали: лсв2р2 и .Щ12рг. Молекулярные орбитали, образованные за счет 2/^-орбиталей, также аналогичны тем, которые образуются за счет 2/?г-орбиталей, но в отличие от последних они повернуты на 90° вокруг межъядерной оси молекулы (рис. 4.27). Молекулярные орбитали ясв2ру и л[В2р, а также п 2р
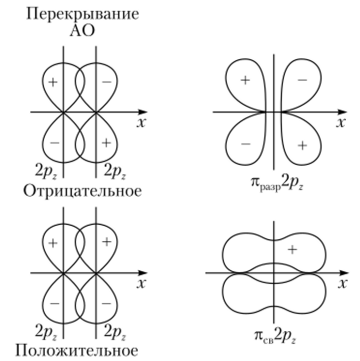
Рис. 4.27. Схема образования связывающей и разрыхляющей молекулярных.
лг-орбиталей и тс 2pz попарно имеют одинаковые энергию и форму, поскольку исходные 2ру- и 2/?,-орбитали характеризуются одинаковой энергией и перекрываются одинаковым способом.
Окончательный вид энергетической диаграммы гомоядерных молекул, образованных за счет атомных 2sи 2р-орбиталей, показан на рис. 4.28. Слева и справа расположены атомные орбитали, взаимодействие которых приводит к образованию молекулярных орбиталей, изображенных в центре. Пунктиром указано участие атомных орбиталей в построении молекулярных.
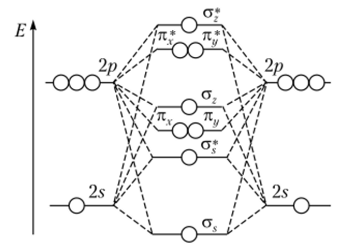
Рис. 4.28. Диаграмма энергетических уровней двухатомных молекул, образующихся из атомных 25- и 2р-состояний.
Для элементов второго периода перекрывание 15-орбиталей настолько незначительно, что их участием в образовании химической связи можно пренебречь. Внутренние электроны обычно рассматривают как несвязывающие, т.с. принадлежащие отдельным атомам.
Исходя из приведенных представлений о формировании МО рассмотрим всю серию возможных молекул от Li2 до F2.
В молекуле Li2 самая слабая и самая длинная одинарная связь, так как она образована за счет 25-орбиталей. Внутренние 152-орбитали каждого атома лития усиливают отталкивание ядер, что приводит к еще большему ослаблению связи.
Бериллий имеет конфигурацию 152252, поэтому в предполагаемой молекуле Ве2 должно быть четыре электрона, из которых два должны располагаться на связывающей молекулярной орбитали, а два — на разрыхляющей. Поэтому по аналогии с гипотетической молекулой Не2 связывающий и разрыхляющий эффекты уравновешиваются и устойчивой молекулы Ве2 не существует.
В молекуле В2 имеется шесть электронов (конфигурация ls22s22pl) на молекулярной орбитали. Два электрона располагаются на а(в-орбитали, а два электрона — на ара;ф-орбитали. Последние же два электрона имеют параллельные спины и занимают разные орбитали, следовательно, ведут себя точно так же, как вели бы себя в атоме в соответствии с правилом Гунда. Таким образом, молекула В9 содержит два неспаренных электрона, каждый из которых занимает псв2ру- и л(.в2р.-орбитали. Длина связи в В2 короче, а энергия связи — больше, чем в Li2.
В молекуле С2 имеется восемь электронов (конфигурация 1522522р2). По два электрона располагаются на асв— и на араф-орбиталях. Остальные четыре электрона образуют псв-р— и л(В-/?2-орбитали.
Из приведенных на рис. 4.29 и 4.30 данных об энергии МО, длине связи и электронных конфигурациях для двухатомных молекул от Li2 до F2 вид 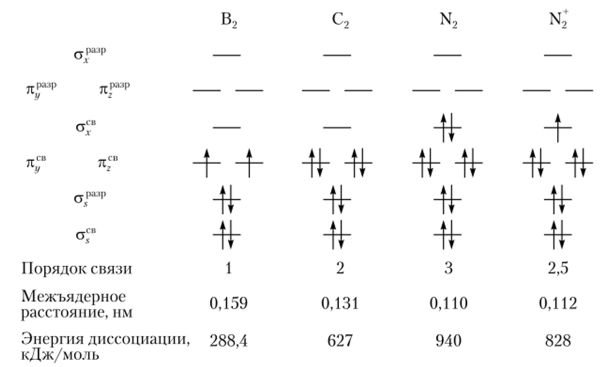
Рис. 4.29. Измерение энергии МО, электронных конфигураций, длины и энергии связей для некоторых двухатомных молекул
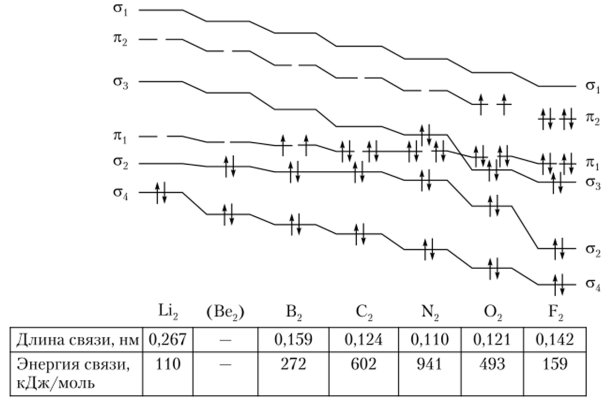
Рис. 4.30. Изменение энергии МО, электронных конфигураций, длины и энергии связей для двухатомных молекул от Li2 до F2.
ны особенности образования молекул N2, 02 и F2, поэтому подробный их разбор опущен. Исходя из этих сведений можно сделать ряд важных выводов:
- а) в ряду В2 —С2 —N2 по мере заполнения молекулярных орбиталей уменьшается длина связи и увеличивается энергия диссоциации молекул;
- б) в ряду N2 — 02 — F2 по мере заполнения разрыхляющих орбиталей межъядерное расстояние возрастает, а энергия диссоциации молекул уменьшается;
- в) удаление электрона с разрыхляющей орбитали приводит к возрастанию энергии диссоциации молекул и уменьшению длины связи (например, в 02 и 02);
- г) удаление электрона со связывающей орбитали приводит к уменьшению энергии диссоциации молекул и увеличению длины связи (например, N2 и Щ);
- д) молекула Ne2 не может существовать вследствие одинакового числа электронов на связывающих и разрыхляющих орбиталях. Аналогично не существуют и Аг2, Кг2, Хе2 и Rn.,.
Теория МО позволяет объяснить ряд важных свойств молекул. Так, распределение электронов на МО влияет на их магнитные свойства. Молекулы, имеющие непарные электроны (В2, 02, Н2— и Не+-ионы), обладают парамагнитными свойствами. Молекулы, в которых все электроны парные (С2, N2, Н2), являются диамагнитными.
Окраска веществ является результатом избирательного поглощения соединением видимой части электромагнитного спектра. Поглощение тех или иных квантов света зависит от особенностей электронов, участвующих в построении связей. Так, электроны, образовавшие a-связи, возбуждаются большими квантами, и поэтому вещества с простыми связями поглощают в далекой ультрафиолетовой части спектра, а квантов видимого спектра они не поглощают и кажутся бесцветными. Электроны, участвующие в построении тг-связей, возбуждаются меньшими квантами. Так, окраска иода объясняется переходом электрона при возбуждении с л:])аф-орбитали на свободную ор1ф-орбиталь, что соответствует поглощению электромагнитного излучения с длиной волны около 520 нм (желто-зеленая часть спектра), поэтому наблюдаемая окраска иода оказывается фиолетовой.
Гетероядерные двухатомные молекулы. Рассмотренную теорию для двухатомных гомоядерных молекул можно использовать и для двухатомных гетероядерных, таких как СО или NO. Сравним, например, молекулы N2 и СО, которые являются изоэлектронными, т. е. эти молекулы характеризуются одинаковым числом электронов и имеют аналогичную картину заселенности молекулярных орбиталей. Следует отметить, что:
- а) все орбитали атома кислорода энергетически ниже, чем соответствующие АО атома углерода, поскольку заряд ядра атома кислорода на две единицы выше;
- б) расщепление 25- и 2р-орбиталей для кислорода по энергии выше, чем для углерода;
- в) в связывающую орбиталь больший вклад вносит орбиталь более электроотрицательного атома, а в разрыхляющую — орбиталь менее электроотрицательного атома;
- г) связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома, разрыхляющие — ближе к орбиталям менее электроотрицательного атома. Следовательно, электроны связывающих орбиталей главным образом пребывают вблизи более электроотрицательного атома. Электронная же плотность на разрыхляющих МО, наоборот, смещена в сторону менее электроотрицательного атома;
- д) различие в энергии исходных АО определяет полярность связи.
В молекуле СО имеются две несвязывающие а-орбитали, на которых располагаются две неиоделенные пары электронов (рис. 4.31).
Одна из орбиталей, наиболее глубокая, принадлежит кислороду и близка по характеру к 5-орбитали. Ее неподеленная пара не отличается реакци 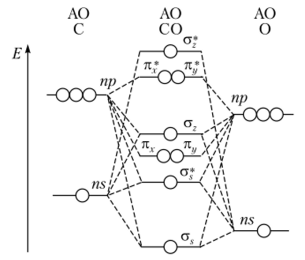
Рис. 431. Диаграмма энергетических уровней гетероядерных двухатомных молекул, образующихся из ns- и ир-атомных состояний онной способностью. Другая орбиталь центрируется на атоме углерода и направлена в противоположную сторону от связи С—О; эта орбиталь имеет выраженный /7-характер. Реакционная способность электронов на данной орбитали объясняет донорные свойства СО.
Из этих данных следует, что наиболее удовлетворительным описанием молекулы СО является наличие тройной связи между углеродом и кислородом и низко расположенных разрыхляющих акцепторных орбиталей.
Трехатомные линейные молекулы. В качестве примера рассмотрим молекулу ВеН." существующую только в газовой фазе. У бериллия 2л-орбиталь может образовать с двумя l. v-орбиталями атомов водорода две комбинации, соответствующие о-связывающей и ст-разрыхляющей МО. При этом 2р — и 2/).-орбитали у бериллия в образовании молекулярных орбиталей участия не принимают и переходят в молекулу ВеН2 в неизменном виде как несвязывающие одноцентровые молекулярные орбитали, принадлежащие только бериллию. Здесь 2рг-орбиталь бериллия также дает две комбинации с l. v-орбиталями водорода с образованием стг-связывающей и.-разрыхляющей орбиталей. Связывающие а — и ах- и разрыхляющие ст(— и стг-орбитали являются трехцентровыми, поэтому осуществляющие химическую связь электронные пары в молекуле Bell., располагают на трехцентровых а*в— и (^"-орбиталях.
Каждая из двух электронных пар в равной степени принадлежит обоим атомам водорода, на основании чего порядок связи Be—Н равен 1, а строение молекулы выражается формулой Н—Be—Н. На рис. 4.32 и 4.33 приведены схемы образования молекулярных орбиталей в ВеН2.
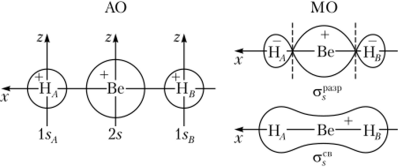
Рис. 4.32. Схема образования связывающей и разрыхляющей аорбиталей ВеН2.
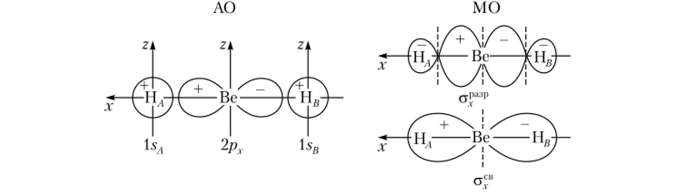
Рис. 433. Схема образования связывающей и разрыхляющей ст-орбиталей ВеН2.
Пятиатомные тетраэдрические молекулы. Классическим примером тетраэдрической пятиатомной молекулы является метан СН4 (см. рис. 4.18). В образовании молекулярной орбитали в СН4 принимают участие 2s-, 2рх-, 2р- и 2р-орбитали углеродного атома и ls-орбитали атома водорода. Комбинация 25-орбиталей атома углерода с четырьмя 1 s-орбиталями атома водорода образует пятицентровые молекулярные ст*в— и СТразр-орбитали, а комбинации 2р-, 2ру-, 2/?г-орбиталей углерода и ls-орбиталей водорода дает три связующие (о'св, &'н и ст,г") и три разрыхляющие (ст‘а:ф, а'а:ф и ст*,.ф) пятицентровые МО. Поскольку каждая из образовавшихся молекулярных орбиталей охватывает все атомы в молекуле СН f и направлена под углом 109,5° к вершине тетраэдра, то по характеру распределения электронной плотности они одинаковы. В невозбужденной молекуле СП, имеется две связывающие и две разрыхляющие МО.
Сравнивая структуры трех-, четырехи пятиатомных молекул, можно сделать два очень важных вывода:
- 1) переход от линейной молекулы к тетраэдрической (ВеН2 — линейная, ВН3 — треугольная, СН, — тетраэдрическая) приводит к тому, что число молекулярных ст-орбиталей увеличивается, а число тг-орбиталей уменьшается;
- 2) в тригонально-пирамидальной молекуле число ст-орбиталей то же, что и в треугольной, но вместо несвязывающей я-орбитали имеется несвязывающая ст-орбиталь.