Кобальт и никель

При взаимодействии солей кобальта (П) с KCN в присутствии окислителей образуется гексацианокобальтат (Ш) калия K3, представляющий собой бледно-желтые кристаллы. При действии серной кислоты на эту соль с последующим выпариванием раствора удается выделить в свободном состоянии сильную трехосновную кислоту H3, В ряду комплексных соединений Со (Ш) наблюдаются следующие виды изомерии: Молекулы Н20… Читать ещё >
Кобальт и никель (реферат, курсовая, диплом, контрольная)
Историческая справка В 1735 г. шведский химик Г. Брандт в руде, добытой в Саксонии, обнаружил и выделил серый, со слабым розоватым оттенком неизвестный металл, который получил название кобальт.
Элемент с порядковым номером 28 — никель — был впервые открыт и описан шведским металлургом А. Ф. Кронстедтом в 1751 г. при изучении руды — купферникеля.
В виде простых веществ кобальт и никель — блестящие белые металлы, кобальт с сероватым, а никель — с серебристым оттенком. По сравнению с железом кобальт и никель — более твердые и хрупкие металлы. Оба металла характеризуются наличием ряда полиморфных видоизменений. Кобальт и никель образуют две аллотропные модификации. а-Со (устойчив до 417°С) и а-Ni (устойчив до 250°С) имеют гексагональные решетки. р-Со и p-Ni, существующие при температурах выше 417 и 250 °C соответственно, характеризуются грансцентрированной кубической решеткой.
В ряду Fe — Со — Ni химическая активность понижается. Рассматриваемые элементы располагаются в ряду стандартных электродных потенциалов левее водорода, но по химической активности уступают железу. В обычных условиях они довольно устойчивы по отношению к кислороду: взаимодействие с ним происходит у кобальта при 300 °C, а у никеля — при 500 °C. При нагревании они взаимодействуют почти со всеми неметаллами — галогенами, серой, селеном, фосфором, мышьяком и др., образуя соединения от солеподобных (СоНа12, NiHal2) до металлических.
Оба металла взаимодействуют с разбавленными кислотами, вытесняя водород и окисляясь до Со (П) и Ni (II). Взаимодействие с кислотами происходит значительно медленнее по сравнению с железом. Концентрированная HN03 пассивирует кобальт и никель.
Соединения кобальта и никеля. В ряду Fe — Со — Ni наблюдается уменьшение стабильности соединений Со и Ni в высших степенях окисления и повышение устойчивости в степени окисления +2. Поэтому если для кобальта удается получить соединения, где степень окисления равна +3 и +4, то для никеля известны только соединения со степенью окисления +2. Лишь в ряде соединений никелю можно формально приписать степени окисления +3 и +4. Относительная простота химии никеля с точки зрения числа состояний компенсируется значительным разнообразием комплексных соединений.
Степень окисления +2 для кобальта наиболее характерна. В этом состоянии он проявляет примущественно координационое число 6, что соответствует октаэдрическому типу пространственных структур.
Оксид кобальта (Н) СоО может быть получен по реакциям.
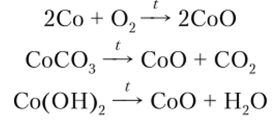
СоО и соответствующий ему гидроксид — Со (ОН)2 являются амфотерными соединениями с преобладанием основных свойств.
Соединения кобальта (П) окисляются значительно труднее, чем железа (П). Со (ОН)2 на воздухе окисляется до Со (ОН)3 с большим трудом, но в присутствии сильных окислителей реакция протекает быстрее.
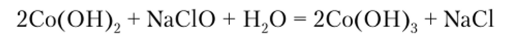
При растворении соединений Со (И) в разбавленных водных растворах кислот образуется розовый аквакомплекс [Со (Н20)6]2+. Такая же окраска сохраняется у кристаллогидратов, например Co (N03)2 • 6Н20, CoS04 • 6Н20, CoS04 -7H20 и др.
При добавлении щелочи к растворам солей кобальта (П) образуется Со (ОП)2, который на холоде имеет голубую окраску, переходящую в грязно-розовую при нагревании. Изменение окраски кристаллогидратов связано с образованием многоядерных комплексов:
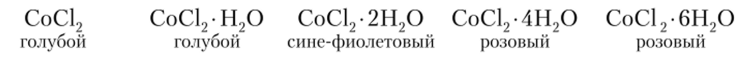
При действии аммиака на безводные соли кобальта (П) образуются соответствующие гексаамминкомплексы [Co (NH3)G|2f, которые в присутствии воды разрушаются с выделением NH3:

Поэтому для стабилизации комплексных аммиакатов их получают в присутствии NH4C1 при большом избытке NH3. Комплексные аммиакаты [Co (NII3)6]2~ легко окисляются в аммиакаты [Co (NH3)6]3+: 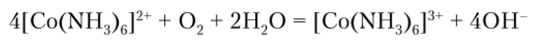
Анионные комплексы [CoXJ2 (где X — Cl, Br, I, ОН, SCN) образуются с галогенид-, псевдогалогениди ОН-ионами:

Большинство известных комплексов Со (П) имеет октаэдрическое или тетраэдрическое строение, причем образование тетраэдрических комплексов кобальта (П) идет значительно легче, чем у любых других ионов переходных металлов.
Качественная реакция на ион кобальта (Н) заключается в том, что полоску фильтровальной бумаги смачивают раствором ZnS04 и соли кобальта (П) и сжигают в пламени горелки, при этом образуется CoZn02, окрашивающий золу в зеленый цвет (зелень Ринмана):
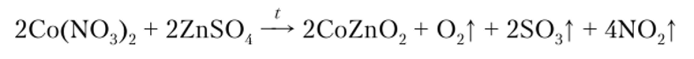
Оксид кобальта (Ш) Со203 может быть получен в смеси с СоО при осторожном нагревании Co (N03)2. Он является сильным окислителем, о чем свидетельствует реакция с концентрированной НС1:
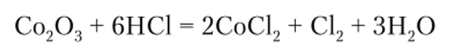
При действии же концентрированных кислородсодержащих кислот происходит восстановление до Со2+ и выделяется 0.;:
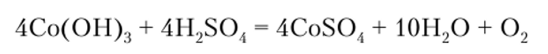
Для иона Со3+ бинарные соединения и соли нехарактерны, но зато известны многочисленные комплексные соединения. Ион Со3+ обнаруживает сильное сродство к N-донорным лигандам (NH3, SCN и др.), образуя с ними большое число комплексов, которые имеют октаэдрическую структуру.
Комплексы Со (Ш) получают окислением Со (Н) в растворах в присутствии соответствующих лигандов. В качестве окислителей используют 02 или Н202:
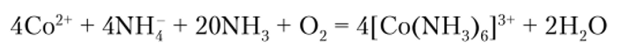
Из катионных комплексов Со (Ш) наиболее устойчивы амминкомплексы. Ион [Co (NH3)(.]3+ желтого цвета образует легко кристаллизующиеся соли с различными анионами. В этих катионных комплексах NH3-rpynnbi могут быть частично замещены на другие лиганды, например [Co (NII3)5C1]2+, [Co (NH3)4C12]2+ и т. д.
Аквакомнлексы Со (Ш) по сравнению с амминкомплексами менее устойчивы, так как являются сильными окислителями:
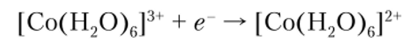
Для иона Со3+ весьма характерны и анионные комплексы, хотя они менее многочисленны по сравнению с катионными. Из анионных комплексов наиболее важными являются гексанитритокобальтаты (Ш), получаемые при взаимодействии раствора смеси Co (N03)9 с нитритами в среде уксусной кислоты. В присутствии NaN02 образуется растворимая в воде соль.
Na3[Co (N02)6]. В присутствии же катиона К+ образуется нерастворимая в воде соль K3[Co (N02)6] в виде ярко-желтого осадка. Этой реакцией пользуются для обнаружения ионов К+ в качественном анализе.
При взаимодействии солей кобальта (П) с KCN в присутствии окислителей образуется гексацианокобальтат (Ш) калия K3[Co (CN)6], представляющий собой бледно-желтые кристаллы. При действии серной кислоты на эту соль с последующим выпариванием раствора удается выделить в свободном состоянии сильную трехосновную кислоту H3[Co (CN)6], В ряду комплексных соединений Со (Ш) наблюдаются следующие виды изомерии:
- • координационная — |Co (NH3)G]|Cr (CN)G] и [Cr (NH3)G||Co (CN)G|;
- • гидратная — [Co (NH3)4C12] С1Н20 и [Co (NH3)4C1(H20)]C12;
- • ионизационная — |Co (NH3)5S04|Br и |Co (NH3)5Br)S04;
- • геометрическая — цис> транс-изомерия.
Соединения Ni (II) очень сходны с соединениями Со (И).
Оксид никеля (Н) NiO и соответствующий ему гидроксид Ni (OH)2 — зеленого цвета. NiO получают разложением NiC03, Ni (OH)2 или Ni (N03)2, а Ni (OH)2 — действием щелочей на соли никеля (П). NiO и Ni (OH)2 в воде не растворяются, но взаимодействуют с кислотами с образованием соответствующих солей, проявляют основные свойства.
Катион Ni2+ образует многочисленные комплексы, проявляя координационные числа 6,5 и 4, наиболее устойчивое из которых 6. Среди комплексных соединений встречаются все типы структур, между которыми могут существовать равновесия, зависящие как от температуры, так и от концентрации.
Для координационного числа 6 наиболее типичным является зеленый аквакатион [Ni (H20)G]2+, образующийся при взаимодействии никеля или NiC03; NiO и Ni (OH)2 с кислотами.
Молекулы Н20 в аквакатионе могут быть замещены на NH3. Образующиеся катионные комплексы [Ni (H20)2(NH3)4]2+, [Ni (NH3)6]2+ обычно окрашены от синего до красного цвета. Изменение окраски комплексов при замене Н20 на внутренней координационной сфере лигандом более сильного поля (в данном случае NH3) связано с соответствующим сдвигом полосы поглощения в сторону меньших длин волн.
Аммиакаты могут быть получены при взаимодействии Ni (OH)2 с NH3 или солями аммония:

У Ni (ll) координационное число 4 характерно для его анионных комплексов, из которых наиболее устойчив [Ni (CN)J2, образующийся по реакции.
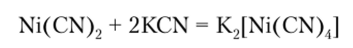
Ni2+ может быть количественно осажден в виде осадка розово-красного цвета из аммиачных растворов его солей с помощью диметилглиоксима (рис. 18.4).
Эта реакция, впервые предложенная Л. А. Чугаевым, используется в аналитической химии для качественного и количественного определения никеля.
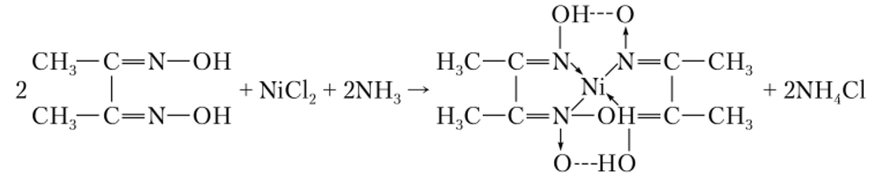
Рис. 18.4. Реакция Л. А. Чугаева.
Биологическая роль кобальта. Наиболее изучена та функция кобальта, которая связана с его непосредственным участием в построении коферментов ряда витамина В12. Молекула имеет сложное строение; общая формула соответствует составу C63H88CoNhOhP, а молекулярная масса — 1355,4. Витамин В12, называемый цианокобаламином, обладает высокой биологической активностью: он является фактором роста, стимулирует кровотворение и созревание эритроцитов, активирует свертывающую систему крови, влияет на обмен углеводов и липидов. Витамин В12 — наиболее эффективный нротивоанемический препарат.
Витамин В]2 — единственный из витаминов, который синтезируется исключительно микроорганизмами. Через почву он попадает в растения, а затем с растениями в организмы животных. Для человека основным эффективным источником витамина В12 служит животная пища.
Биологическая роль никеля изучена еще недостаточно.