Скрытая теплота испарения.
Давление насыщенного пара

Более точные зависимости давления насыщенного пара от температуры приводятся, например, в «Океанологических таблицах», табл.5.39, а также в специальных психрометрических таблицах. Аналогичным образом можно представить и давление насыщенного пара надо льдом, в этом случае вместо теплоты испарения L используют L' так называемую теплоту сублимации или возгонки L', первая величина при 0 °C равна… Читать ещё >
Скрытая теплота испарения. Давление насыщенного пара (реферат, курсовая, диплом, контрольная)
Энергия взаимодействия океана и атмосферы в значительной степени зависит от фазовых переходов между жидкостью, паром и льдом. Условием равновесия двух фаз для системы вода-пар-лед будет равенство их химических потенциалов:

Таким образом, должна существовать функция f (p, T), которая и будет соответствовать равновесному сосуществованию этих фаз. При заданной температуре Т пар и вода будут в равновесии, если давление пара над ровной поверхностью воды имеет значение р,"(Т), называемое давлением насыщенного пара. В случае равновесного фазового перехода, очевидно, энтропия системы, состоящей из жидкости и пара, а также ее объем будет меняться. Пусть единица массы воды с удельным объемом Vi и энтропией тр переходит в пар, имеющий энтропию т|2 и удельный объем V2. Исходя из уравнения Гиббса-Дюгема (3.1.26), равенство химических потенциалов (3.18.1) будет означать, что:
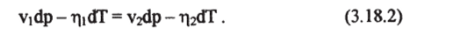
Отсюда следует, что:
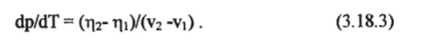
При постоянной температуре Т из уравнения (2.4.3) следует, что разность т|2-т|1 = AQ/T. Количество тепла AQ, необходимого для испарения жидкости единичной массы, называется удельной скрытой теплотой испарения (парообразование) и обозначается обычно буквой L. Окончательно выражение (3.18.3) для изменения давления насыщенного пара р*, находящегося в равновесии с жидкостью, будет выглядеть так: 
Эго — уравнение Клаузиуса-Клапейрона. Величина L называется «скрытой» теплотой потому, что при переходе жидкости в пар это тепло от жидкости «отнимается», но не происходит одновременного непосредственного нагрева окружающей воздушной среды. Нагрев может происходить только при обратном фазовом переходе — конденсации водяного пара, и этот процесс может происходить в другое время и в другом месте. Теплоту парообразования при постоянном давлении можно трактовать также как разность энтальпий единицы массы воды в парообразном и жидком состояниях.
В формуле (3.18.4) при исследовании равновесия вода-пар вместо разности удельных объемов можно использовать значение только удельного объема пара, поскольку характерные значения при 0 °C v, = 10'3 м3-кг-1, a v2 = 206 м3 кг '. Но поскольку уравнение КлаузиусаКлапейрона имеет универсальный характер и применимо для других фазовых переходов (лед-пар и вода-лед), в последнем случае разница удельных объемов составляет величину порядка 10-5м3-кг1 и градиент dp/dT на несколько порядков больше, чем при переходе вода-пар.
Зная величину р*о для одной из температур Т0 и соответствующую удельную теплоту парообразования Lo, можно выразить значения давления насыщенного пара при любой другой температуре. Интегрируя уравнение Клаузиуса-Клапейрона и выражая удельный объем пара vv в соответствии с уравнением состояния идеального газа vv= R, T/p, получим следующую зависимость давления насыщенного пара от температуры (Ro — универсальная газовая постоянная):
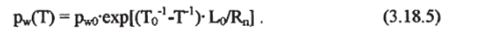
Более точные зависимости давления насыщенного пара от температуры приводятся, например, в «Океанологических таблицах», табл.5.39 [1974], а также в специальных психрометрических таблицах. Аналогичным образом можно представить и давление насыщенного пара надо льдом, в этом случае вместо теплоты испарения L используют L' так называемую теплоту сублимации или возгонки L', первая величина при 0 °C равна 2,50-Ю6 Дж-кг1, а вторая несколько больше — 2,83−106 Дж-кг-1 [Доронин, 1978]. Для сравнения напомним, что удельная теплота плавления пресного льда L, представляющая разность энтальпий жидкой и твердой фазы, составляет 0,335−106 Дж-кг1. Для фазового перехода вода-лед уравнение (3.18.4) также можно проинтегрировать и, с учетом малых изменений удельных объемов воды vw и льда V; вблизи температуры замерзания получить следующую зависимость [Доронин, 1978]:

До сих пор все рассуждения в этом параграфе не рассматривали влияния солености на равновесие фаз. В формуле (3.18.1) при рассмотрении равенства химических потенциалов необходимо учесть зависимость ц- |V (p, T, S). В соответствии с законом Рауля, давление насыщенного пара растворителя у разбавленных идеальных растворов пропорционально относительной доли растворителя (чистой воды) в этом растворе и давлению пара растворителя без примеси. Морская вода не является идеальным раствором и парциальное давление насыщенного пара над нею несколько меньше того, которое следует из закона Рауля. Тем не менее, может быть построена простая эмпирическая зависимость pw(S)=rf (pw(0), S), в соответствии с работой [Fofonoff, 1962] она выглядит так (S — практическая соленость, епс):
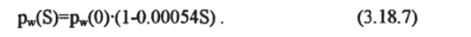
Понижение давления насыщенного пара над морской водой по сравнению с пресной невелико — менее 2% д ля океанического диапазона солености.
Все возможные фазовые переходы в системе вода-лсд-пар представлены на диаграмме фазовых состояний пресной воды и морской воды при солености 35 единиц как функции температуры и.
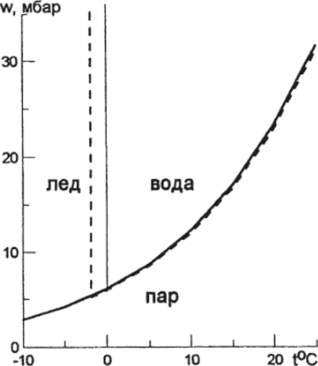
Рис. 3.18.1. Диаграмма фазовых состояний. Сплошные линии — пресная вода, пунктирные — соленость 35 епс.
давления насыщения (рис. 3.18.1). Кривые на этом рисунке соответствуют линиям раздела фаз, при температурах ниже температуры замерзания давление насыщающего пара над водой и льдом различаются лишь незначительно. Обращает на себя внимание почти вертикальная линия раздела между водой и льдом и существование точки пересечения кривых вблизи температуры замерзания воды, в которой могут сосуществовать в равновесии все три фазы. Ога точка называется тройной, для пресной воды она соответствует 0,0 ГС, для соленой воды ее температура также выше температуры замерзания примерно на такую же величину.
Скрытая теплота испарения для всего диапазона температур может быть получена по давлению насыщенного пара. Зависимость L=f (Lo>pw, T) следует из уравнения (3.18.4). Зная величину давления насыщенного пара для одной из температур, можно выразить величину L (t) для пресной воды как функцию одной температуры. Наиболее точная эмпирическая формула приводится в работе [Siedler, Peters, 1986|:
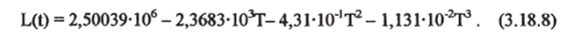
где Т — температура,°С, удельная теплота парообразования выражена в Дж-кг'1. Если рассчитать производную 3L/5S исходя из приближенных уравнений (3.18.4) и (3.18.7) и производной для химического потенциала Зр/dS [Fofonoff, 1962J, то можно получить зависимость удельной теплоты парообразования от концентрации солей. Для морской воды при при океанической солености значение L должно отличаться в меньшую сторону от величины для пресной воды не более чем на З-Ю3 Дж-кг'1 или 0,12% [Siedler, Peters, 1986], и в реальных расчетах поправка на соленость не вводится. Зависимость ЦТ) практически линейно уменьшается от 2,50 МДж-кг1 при 0 °C до 2,43 М Дж-кг'1 при 30 °C.
В заключение этого параграфа приведем также упрощеннную формулу для расчета скрытой теплоты сублимации L' в Дж-кг1 [Гилл,.
1986|:
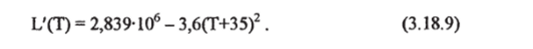
При температуре 0 °C удельная теплота сублимации на 13% выше, чем теплота испарения.