Теплоемкость морской воды

Вода обладает наиболее высокой теплоемкостью из большинства веществ (кроме водорода и жидкого аммиака). Это имеет огромное значение для формирования климатических условий на Земле. Так, например, простые расчеты показывают, что при охлаждении на 1 °C единица объема воды нагревает на 1 °C почти 3200 объемов воздуха (см. задачу 4.13). Вода отдает атмосфере огромное количество тепла, уменьшая тем… Читать ещё >
Теплоемкость морской воды (реферат, курсовая, диплом, контрольная)
Теплоемкость относится к калорическим свойствам термодинамических систем, так как для ее определения необходимо знать внутреннюю энергию системы[1]. Под теплоемкостью подразумевается количество теплоты, необходимое для изменения температуры системы на один градус (1° С или 1° К), т. е.

Размерность теплоемкости в СИ: (Дж-К1). Отметим, что теплоемкость не является функцией состояния системы, так как количество теплоты 5Q, необходимое для изменения температуры системы на dГ, зависит от характера протекающего при этом процесса. Это означает, что при нагревании одна и та же система в зависимости от происходящего в ней процесса обладает различными теплоемкостями. Однако теплоемкости при постоянном давлении Ср и постоянном объеме Су являются функциями состояния и поэтому они получили наибольшее практическое значение.
Первое начало термодинамики позволяет найти значения различных теплоемкостей и установить связь между ними, если известны калорическое (2.2) и термические (2.3) уравнения состояния системы. В случае сложных систем с несколькими компонентами, когда внутренняя энергия зависит от внешних параметров а, — и температуры Г, а работа может быть получена в соответствии с (2.1), первое начало термодинамики выглядит так:
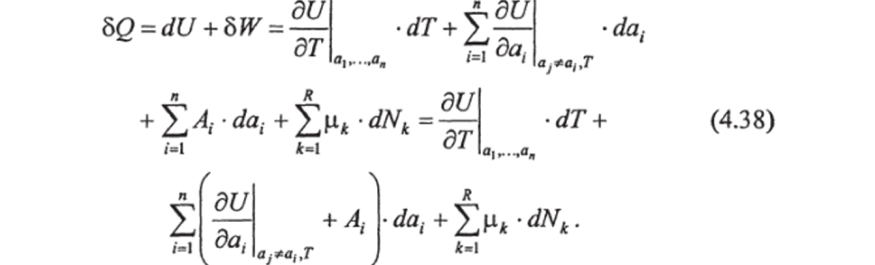
Тогда, разделив выражение (4.38) на dTy получим:
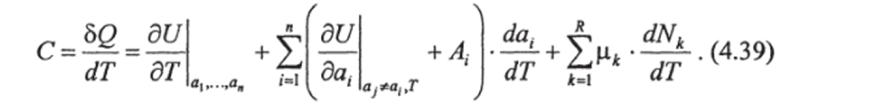
Применим уравнение (4.39) к морской воде как двухкомпонентной системе, находящейся под действием только равностороннего давления. Получим:
Выражение (4.40) записано в удельных величинах, где с — удельная теплоемкость (с=С/М), определяющая количество теплоты, необходимое для нагревания единицы массы морской воды на один градус (Дж кг '-Ю1); е — удельная внутренняя энергия; v — удельный объем; 5 — соленость; р. — химический потенциал морской воды.
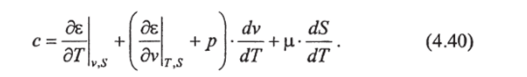
Приняв постоянными удельный объем и соленость, из (4.40) получим удельную теплоемкость морской воды при постоянном объеме и постоянной солености:
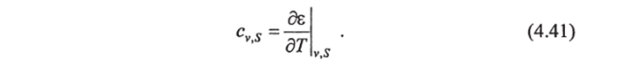
Удельную теплоемкость морской воды при постоянном давлении и постоянной солености можно найти из уравнения (4.40):
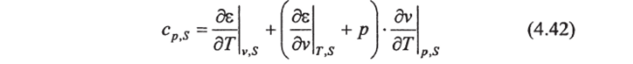
или, принимая во внимание (4.41),.
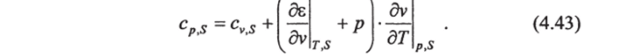
Из уравнения (4.41) следует, что для определения с" надо знать лишь калорическое уравнение состояния. Для определения же ср необходимы как термические, так и калорическое уравнения состояния системы. Чтобы избавиться в выражении для ср от калорического уравнения (т. е. от внутренней энергии), воспользуемся вторым началом термодинамики, с помощью которого можно установить связь между термическими и калорическим уравнениями состояния.
Действительно, из основного уравнения термодинамики для морской воды (3.9) находим (раскрывая полный дифференциал de):

Выражение (4.49) можно вычислить, если заданы две функции состояния р и v, что не всегда возможно. Поэтому преобразуем (4.49) к виду, в который входит только удельный объем.

Для морской воды отношение -^-близко к единице23. Выражение (4.51) можно переписать в следующем виде:
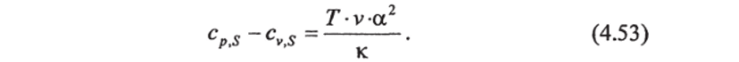
В случае устойчивого равновесного состояния океана, т. е. коду гда плотность воды с глубиной увеличивается, — 0,.
<^r.s.
из уравнения (4.53) находим, что с s > cvS. Равенство выполняется только при а=0. Например, для пресной воды а=0 при температуре 3,982° С и стандартном атмосферном давлении. При этих значениях ее плотность максимальна, а, а меняет знак. Для солоноватых вод (0 < S 24, б) а=0 при температуре наибольшей плотности. В случае морских вод (^>24,6) равенство cp S = cvS никогда не достигается, так как а>0 при всех температурах.
В заключение теоретического описания понятия теплоемкости, кратко остановимся на ее связи с некоторыми термодинамическими потенциалами.
Из определений энтропии (2.9) и теплоемкости (4.37) следует:
Откуда:

Из (3.12) видно, что при изобарических процессах и постоянной солености изменение энтальпии равно:
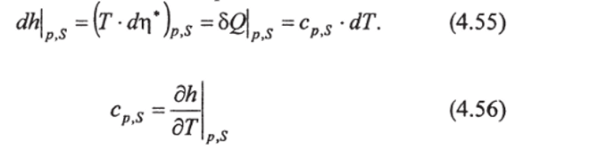
- 23 Одним из самых точных экспериментальных способов определения у является измерение скорости звука в морской воде.
- 24 Физически это объяснимо. При постоянном давлении для нагревания системы на градус необходимо больше тепла, чем при постоянном объеме, так как в первом случае часть тепла системы идет на совершение работы, которая происходит вследствие увеличения объема.
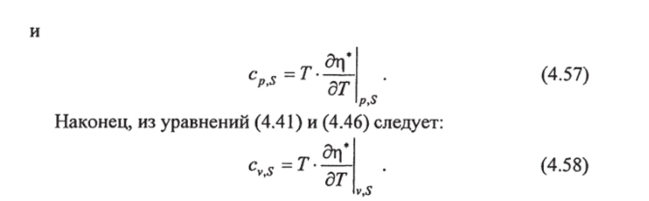
С помощью формул (4.57) и (4.58) устанавливаются зависимости теплоемкостей от давления и удельного объема. Продифференцировав (4.57) по давлению при постоянной температуре и постоянной солености, меняя затем порядок дифференцирования и используя соотношение Максвелла (2.281. имеем:
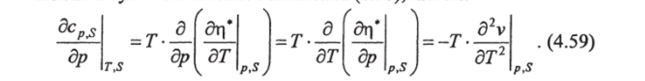
Аналогично можно получить зависимость cv от удельного объема, используя соотношение взаимности (2.24):
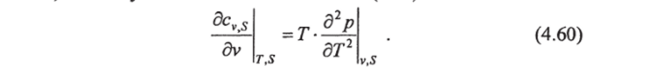
Могут быть получены и другие производные теплоемкостей, но они не представляют практического интереса.
Первые исследования теплоемкости морской воды были проведены в 1889 г. Туле и Шевалье. Несмотря на недостоверность их результатов, данные, полученные ими, применялись в океанологии более 50 лет. В 1959 г. Р. Коксом и Н. Смитом были проделаны точные лабораторные опыты по определению теплоемкости, на основании которых были опубликованы данные по удельной теплоемкости ср морской воды при различных значениях температуры, солености и атмосферном давлении. Опыты по определению удельной теплоемкости морской воды проводились также Д. Конорсом [54] и др.
Самые современные исследования удельной теплоемкости растворов стандартной морской воды были проведены Ф. Миллеро и др. [80]. Данные этих авторов, нормированные на температуру по МПШТ-68, приведены в новых Международных океанографических таблицах [69].
Удельная теплоемкость при атмосферном давлении рассчитывается по эмпирической формуле:
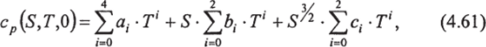
где 0(0=4,2174−103; а,=-3,720 283; а2=0,1 412 855; а3=-2,654 387−10'3; а4=2,93 236 10'5; Ь0=-1,643 575; *,=0,1 072 763; 62=-l, 38 385 10'3; с0=0,1 770 383; c,=-4,7 718 10'3; с2=5,148−10 s.
Коэффициенты в уравнении (4.61) приведены в соответствие с системой СИ, МПШТ-68 и ГПИС-78 [63]. Формула справедлива в следующих диапазонах солености и температуры: 0<5<40, 0<735°С. Проверочное значение: су=3980,0513 Дж кг1оК'1 при •S=40, Г=35° С. Стандартное отклонение данных, полученных по формуле (4.61), составляет 0,5 Дж кг'1-°К'1. Зависимость ср от солености и температуры при атмосферном давлении приведена на рис. 4.11а.
Зависимость удельной теплоемкости ср от давления не может быть измерена непосредственно. Ее можно получить интегрированием уравнения (4.59):
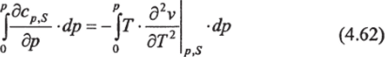
Откуда следует, что:
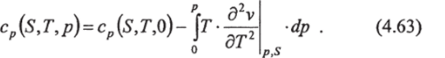
Второй член в правой части (4.63) отражает зависимость удельной теплоемкости от давления, выраженную через удельный объем воды, который можно оценить по экспериментальным данным. В работе [63] по табличным значениям этого члена с помощью метода наименьших квадратов получена его аппроксимация степенными полиномами. В результате уравнение (4.63) преобразуется к виду:
Формула (4.64) справедлива в диапазоне: 0<5<40, 0^Г<35° С, 0</?<1000 бар. Проверочное значение: ср=3849,50 Джкг'^К'1 при 5=40, 7=40° С и /7=1000 бар. Стандартное отклонение теплоемкостей, полученных по полиному, от теплоемкостей, вычисленных прямым интегрированием, меньше 0,1 Дж кг '^К'1.
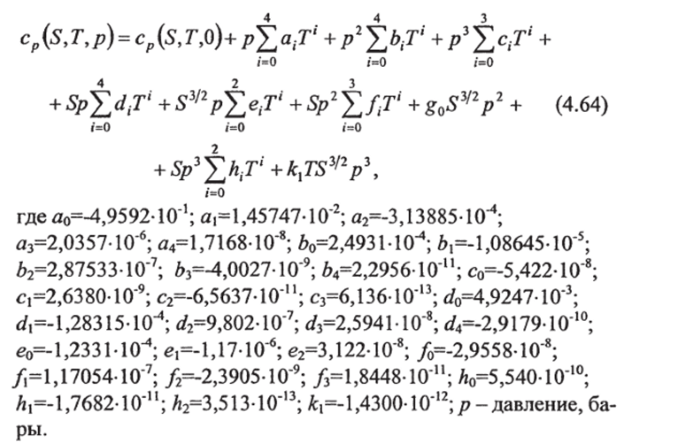
Вода обладает наиболее высокой теплоемкостью из большинства веществ (кроме водорода и жидкого аммиака). Это имеет огромное значение для формирования климатических условий на Земле. Так, например, простые расчеты показывают, что при охлаждении на 1 °C единица объема воды нагревает на 1 °C почти 3200 объемов воздуха (см. задачу 4.13). Вода отдает атмосфере огромное количество тепла, уменьшая тем самым амплитуды колебаний температуры воздуха на большей части поверхности Земли, особенно над самим океаном и прибрежными областями материков, создавая здесь морской климат.
Удельная теплоемкость морской воды уменьшается с увеличением, как солености, так и давления (рис. 4.11). В первом случае увеличивается доля солей в морской воде, обладающих меньшей теплоемкостью, во втором — при больших давлениях происходит сжатие воды и, как следствие, ее дополнительное нагревание. Значит, воде уже надо дать меньше тепла, чтобы ее нагреть на один градус.
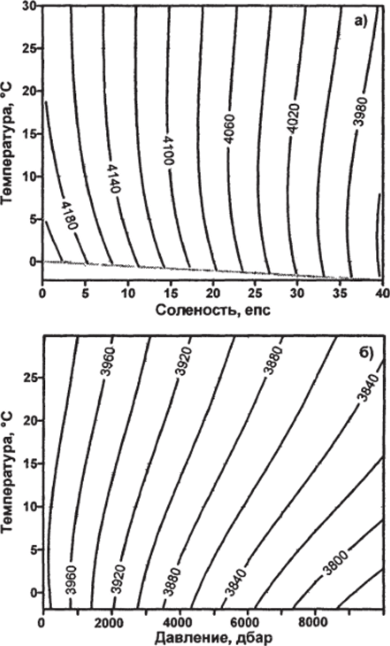
Рис. 4.11. Зависимость удельной теплоемкости при постоянном давлении ср (Джкг] оК1) от солености и температуры при атмосферном давлении (а), давления и температуры при S=35 епс (б).
Поведение удельной теплоемкости морской воды при постоянном давлении от температуры воды сложнее. При атмосферном давлении в водах с соленостью большей, чем примерно 5 епс, удельная теплоемкость сначала уменьшается, и только потом начинает расти, причем при повышении солености начало повышения теплоемкости смещается в область низких температур воды. Удельная теплоемкость при постоянном давлении при соленостях меньших 5 епс уменьшается при повышении температуры.
Как видно из рис. 4.11а, самый значительный фактор, влияющий на изменение удельной теплоемкости, — это соленость морской воды.
Средняя удельная теплоемкость морской воды Мирового океана при постоянном давлении р, рассчитанная по средним значениям солености S и температуры Т, равна примерно 3987 Джкг'^К'1. Для сравнения удельная теплоемкость воздуха при постоянном давлении равна примерно 1005 Дж кг'1оК'1, гранита — 840 Джкг^К'1.
- [1] Помимо теплоемкости, другой важной калорической величиной является теплота изотермического изменения какого-либо внешнего параметра системы (например, объема) — количество теплоты, необходимое для увеличения этого параметра на единицу при постоянстве температуры и внешних параметров.