Уровни энергии и спектры атомов щелочных металлов

Здесь первый член описывает энергию взаимодействия валентного электрона с положительным зарядом, сосредоточенным в центре атома, второй член — энергию взаимодействия с электрическим диполем и т. д. Этим предполагается, что распределенный по объему атома заряд остова можно представить в виде разложения по мультиполям. Каждый последующий член в (3.61) является малым по сравнению с предыдущим… Читать ещё >
Уровни энергии и спектры атомов щелочных металлов (реферат, курсовая, диплом, контрольная)
Группа атомов щелочных металлов — литий, натрий, калий, рубидий, цезий — непосредственно следует за благородными газами. Эти газы имеют завершенную структуру электронных оболочек, что объясняет их слабую химическую активность и высокие ионизационные потенциалы (см. прил. 1). Добавленный к такой структуре электрон в атомах щелочных металлов является как бы «лишним», поэтому он слабо связан в атоме. Это объясняет, почему щелочные металлы химически активны и обладают наименьшими потенциалами ионизации. Их химические и оптические свойства определяются именно этим одним электроном, который называют валентным. Валентные электроны атомов щелочных металлов находятся в 5-состояниях, которые характеризуются разными значениями главного квантового числа. Из прил. 1 можно определить, в какой оболочке находится валентный 5-электрон: Li — 25, Na — 35, К — 45, Rb — 55, Cs — 65.
На основании сказанного может показаться, что уровни энергии атомов щелочных металлов аналогичны уровням водородоподобного атома. Однако между ними имеется существенное различие. В случае водородоподобного атома электрон взаимодействует с ядром по закону Кулона. В атоме щелочного металла валентный Z-й электрон находится в электрическом поле, образованном зарядом ядра Ze и остальными Z- 1 электронами атома. Они называются электронным остовом. В этом случае электрическое поле уже не является кулоновским, так как электронный заряд распределяется по всему объему атома. Электронный остов образует структуру атома благородного газа. Эта структура является завершенной и симметричной в пространстве, поэтому электрическое поле электронного остова можно считать сферически симметричным, т. е. не зависящим от углов. Это значит, что энергию взаимодействия валентного электрона с остовом атома, в общем, можно представить в виде:

Здесь первый член описывает энергию взаимодействия валентного электрона с положительным зарядом, сосредоточенным в центре атома, второй член — энергию взаимодействия с электрическим диполем и т. д. Этим предполагается, что распределенный по объему атома заряд остова можно представить в виде разложения по мультиполям. Каждый последующий член в (3.61) является малым по сравнению с предыдущим. Величина Za характеризует эффективный заряд электронного остова. Для щелочных металлов Za= 1, для однозарядных ионов типа 4Ве+ Za = 2, для двухзарядных ионов типа 5В2+ Za = 3 ит. д.
Ограничимся дальше лишь первыми двумя членами разложения. Тогда угловая часть уравнения Шредингера будет такой же, как в случае водородоподобного атома. В уравнение Шредингера для радиальной волновой функции (3.7) вместо энергии Zae2/4ne0r надо подставить выражение Zae2/4ne0rH-CjZae2/4ne0r2 из (3.61). Это приводит к тому, что вместо двух последних выражений в скобках (3.7) будем иметь.
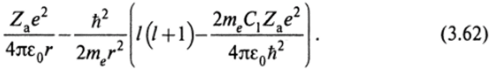
Если ввести обозначение.
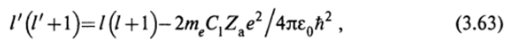
то вместо (3.7) получим уравнение аналогичного вида:

Ограниченное решение, допускающее возможность нормировки волновой функции, существует только при условии, аналогичном (3.16):

Квантовое число /', согласно (3.63), не является целым числом:

Здесь в подкоренном выражении первый член намного превосходит второй. Поэтому можно приближенно написать:
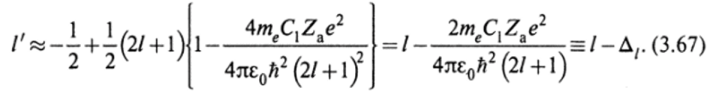
Таким образом, из (3.65) следует, что уровни энергии атомов щелочных металлов определяются формулой:

где я — главное квантовое число, n = nr + / + 1. Величину Д, называют квантовым дефектом. В отличие от формулы (3.18) для водородоподобного атома уровни энергии атомов щелочных металлов зависят не только от главного, но и от орбитального квантового числа. Это означает, что при одном и том же значении числа п уровни энергии различны для разных значений числа /. В этом случае говорят, что происходит устранение вырождения по орбитальному квантовому числу. С возрастанием орбитального квантового числа роль поправки Д, ослабевает (табл. 5), поэтому зависимость энергии щелочного атома от числа / при больших его значениях практически незаметна. Спектральные термы для атомов щелочных металлов определяются формулой.

Рис. 3.12.
Такая формула была эмпирически найдена Ридбергом еще в XIX в.
Таблица 5.
Элемент. | до*д. | д| *д. | Д2 Ш Д(/. | д,. д,. |
Li. | 0,412. | 0,041. | 0,002. | 0,000. |
Na. | 1,373. | 0,883. | 0,010. | 0,001. |
К. | 2,230. | 1,776. | 0,146. | 0,007. |
Rb. | 3,195. | 2,711. | 1,233. | 0,012. |
Cs. | 4,131. | 3,649. | 2,448. | 0,022. |
Рассмотрим уровни энергии атома лития (рис. 3.12). Его основное состояние — 225½. Первый возбужденный уровень — 22Р с энергией возбуждения 1,85 эВ. Устранение вырождения приводит к отличию структуры спектральных серий атома лития от серий атома водорода. В соответствии с правилами отбора возможны переходы в основное состояние со всех возбужденных /7-уровней. Эти переходы вызывают излучение, спектральные линии которого относятся к главной серии.
Эта серия легко наблюдается как в испускании, так и в поглощении. В частности, факт поглощения холодными парами лития, например красной линии, соответствующей переходу 25-+ 2/7, означает, что 25-состояние является основным, нормальным состоянием. Другие спектральные серии связаны с разрешенными переходами между возбужденными уровнями энергии:
- • первая побочная, или диффузная, серия соответствует переходам между 2р- и тг/-уровнями (т- 3, 4, 5…);
- • вторая побочная, или резкая, серия возникает при переходах между 2/7- и т5-уровнями;
- • серия Бергмана, или фундаментальная, серия наблюдается при переходах между 3d- и mf-уровнями (т = 4, 5, 6).
Все эти серии наблюдаются в спектрах испускания. Линии главной серии наиболее интенсивны. Аналогичные серии характерны для всех других атомов щелочных металлов — Na, К, Rb, Cs — с учетом того, что их основными состояниями являются соответственно 35, 45, 55, 65. Главную, резкую и диффузную серии в спектрах щелочных металлов открыли в 1879 г. (Ливинг, Дюар). Фундаментальная серия открыта в 1907 г. (Бергман).
Рассмотрим диаграмму Гротриана для атома натрия (рис. 3.13). Головная линия главной серии является резонансной линией, и представляет собой желтый дублет с близкими длинами волн: Х, = 589,59 нм, Х2 = 588,99 нм. Следующая за ней линия этой серии, соответствующая переходу 354/7, находится в ультрафиолете — Х = 330,20 нм и т. д. Дублетность линий вызвана тонкой структурой /7-уровней. Формула тонкой структуры для атомов щелочных металлов аналогична (3.38) с заменой Z на Z^=Z-a, где величина а характеризует экранирование заряда ядра Z- 1 электронами электронного остова.
С увеличением порядкового номера элемента тонкое расщепление резонансно-возбужденного состояния 2/7,у2 — 2ру2 существенно возрастает (табл. 6). Расщепление для атомов рубидия и цезия столь велико, что называть его «тонким» можно только условно.
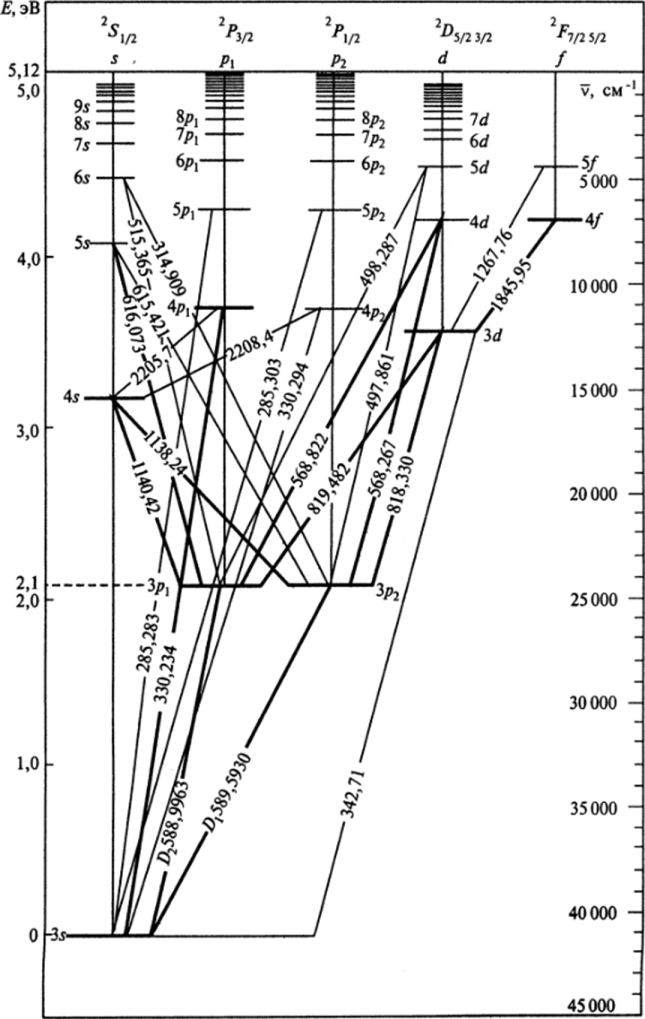
Рис. 3.13.
Эле мент. | Основное состояние валентного электрона. | Энергия возбужденного состояния, эВ. | Тонкое расщепление (см-1). СОСТОЯНИЯ 2р|/2 _ 2Рз/2. | |
2Р/г | 2Ру2 | |||
Н. | 1^,/2. | 10,2. | 10,2. | 0,365. |
Li. | 1,85. | 1,85. | 1,35. | |
Na. | 3^/2. | 2,1. | 2,1. | 17,20. |
К. | 4Ч/2. | 1,61. | 1,62. | 57,7. |
Rb. | 5^/2. | 1,56. | 1,59. | 237,6. |
Cs. | 6^/2. | 1,39. | 1,45. | 554,1. |
ЗАДАЧИ.
1. Пользуясь данными табл. 5, определить потенциал ионизации и первый критический потенциал атома натрия.
Решение. V. = —Rhc =5,1 В; У =2,1 В.
- (3−1.37 f
- 2. Найти значение расщепления первого резонансно-возбужденного состояния атома калия, если заданы длины волн резонансного дублета: 769,898* 10″11 см и 766,49 М0'11 см.
Ответ. Ду%57,7см"*.
3. Сколько спектральных линий возникает при разрешенных правилами отбора переходах атома лития из состояния 4S в основное состояние?
Ответ. 6.