Выращивание кристаллов из низкотемпературных растворов

В широком смысле под раствором подразумевается макроскопически гомогенная смесь разных веществ. Получение кристаллов традиционно основано на бинарных системах, в которых жидкость является растворителем, а другое соединение — растворяемым компонентом. Практически в любой подобной системе, помимо двух основных компонентов, в подчиненном количестве содержатся примеси. Зачастую их вводят в раствор… Читать ещё >
Выращивание кристаллов из низкотемпературных растворов (реферат, курсовая, диплом, контрольная)
Классические разновидности метода
К низкотемпературным растворам обычно относят такие среды, в которых кристаллизация осуществляется ниже 100 °C, т. е. температуры кипения воды — самого распространенного растворителя. Благодаря относительной технической доступности и возможности широкого варьирования параметров роста этот способ выращивания кристаллов является наиболее распространенным.
В широком смысле под раствором подразумевается макроскопически гомогенная смесь разных веществ. Получение кристаллов традиционно основано на бинарных системах, в которых жидкость является растворителем, а другое соединение — растворяемым компонентом. Практически в любой подобной системе, помимо двух основных компонентов, в подчиненном количестве содержатся примеси. Зачастую их вводят в раствор преднамеренно, с той или иной целью. Следовательно, при выращивании из растворов химический состав кристаллов значительно отличается от состава исходной жидкой фазы. На ход кристаллизации существенное влияние оказывает состав растворителя. В частности, возможность его адсорбции на растущей поверхности изменяет характер гетерогенных реакций на межфазной границе «кристалл — раствор».
В основу выращивания кристаллов из растворов положена зависимость растворимости вещества от температуры и типа растворителя. Растворимость, или максимальное количество вещества, способное раствориться при заданной температуре, у большинства соединений монотонно повышается при нагревании, т. е. они характеризуются положительным температурным коэффициентом растворимости (ТКР). В обратном случае речь идет об отрицательном ТКР.
Типичная диаграмма растворимости веществ с положительным коэффициентом растворимости, построенная в координатах «температура (Г) — концентрация (С)», приведена на рис. 3.5. Все поле диаграммы делится кривой насыщенных растворов (сплошная линия) на две области — ненасыщенных (L) и пересыщенных растворов (S) — лежащие, соответственно, ниже и выше нее. Растворы бесконечно долго могут находиться в равновесии с твердой фазой, относительно которой они насыщены. Пересыщенные растворы содержат избыток растворенного вещества по сравнению с равновесным. В зависимости от степени этого избытка область пересыщенного состояния можно разделить на две зоны — метастабильную (самая верхняя часть диаграммы — М) и лабильную (L), находящуюся в крайне нестабильном состоянии, при котором даже незначительные самопроизвольные флуктуации концентрации вещества инициируют формирование кристаллических зародышей. Метастабильные растворы достаточно устойчивы, и для образования в них зародыша критического размера требуется затрата определенной энергии. В растворах, отвечающих границе между метастабильной и лабильной областью на диаграмме Г — С (условная штриховая линия), несмотря на высокую концентрацию растворенного вещества, самопроизвольная кристаллизация не происходит. Ширина метастабильного участка не является постоянной и зависит от природы раствора, протекающих в нем процессов, степени очистки используемых реактивов и многих других факторов.
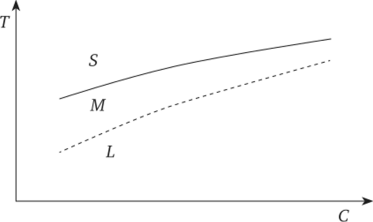
Рис. 3.5. Схема диаграммы растворимости вещества с положительным коэффициентом растворимости (Совр. крист., 1980).
Управляемый рост возможен только в метастабильной области. Пересыщение раствора АС, характеризующее степень отклонения системы от равновесия, является д.с.к. процесса. При расчетах чаще всего определяют так называемое относительное пересыщение ДС/С0, но на практике удобнее использовать величину АТ, представляющую собой разность между температурой насыщения данного раствора Т0 и температурой кристаллизации Т, т. е. переохлаждение. Однако в тех случаях, когда растворимость вещества неизвестна, оценить степень отклонения системы от равновесия с помощью переохлаждения можно лишь весьма приблизительно.
Существующие методы получения кристаллов из растворов различаются, прежде всего, способом задания пересыщения в зависимости от величин растворимости и ТКР [16].
1. Если, независимо от величины растворимости, ТКР вещества существенно отличается от нуля, требуемое пересыщение создают изменением температуры раствора. При этом возможно проведение кристаллизации либо за счет перепада температуры между различными частями кристаллизатора, либо повышением (или понижением) температуры во всем объеме раствора.
В первом варианте постоянное растворение вещества в одной зоне кристаллизатора с повышенной температурой обеспечивает рост кристалла в другой его, более низкотемпературной, зоне. Перенос вещества из одной секции в другую происходит в результате естественной или вынужденной конвекции. Для практической реализации метода в основном используют два соединенных между собой сосуда (рис. 3.6) с термоизолированными соединительными трубками.
Вариант равномерного изменения температуры во всем объеме раствора целесообразно применять при высоких значениях как растворимости, так и ТКР. При этом скорость повышения или понижения рассчитывается исходя из диаграмм состояния вещества, с тем чтобы не допустить перемещения точки «состав — температура» из метастабильной в лабильную область. Для выращивания кристаллов таким способом используется кристаллизатор с термостатом, изображенный на рис. 3.7.
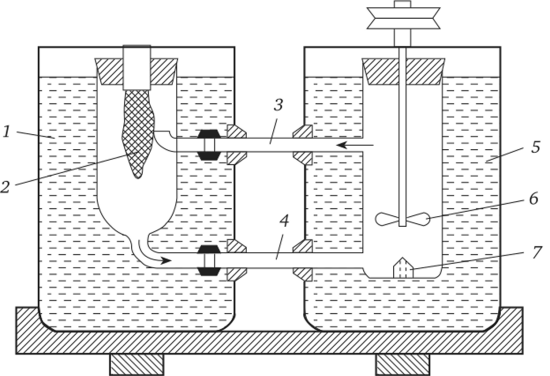
Рис. 3.6. Схема кристаллизационной установки для выращивания кристаллов методом температурного перепада (Совр. крист., 1980):
1 — сосуд для растворения вещества с температурой Тх; 2 — исходное вещество; 3,4 — соединительные трубки; 5 — сосуд для роста кристалла с температурой Т2, Tj > Г2; 6 — мешалка; 7 — растущий кристалл Контроль за спонтанным выпадением кристаллов осуществляется предварительным прогревом кристаллизатора и перегревом раствора выше точки насыщения; затравочный кристалл либо подвешивается на специальном держателе, либо фиксируется на платформе на дне кристаллизатора. Герметично закрытый сосуд термостатируют и задают программу снижения температуры раствора, создавая необходимое для кристаллизации пересыщение. Равномерному притоку питающего вещества к растущему кристаллу и повышению его качества способствуют устройства, позволяющие вращать затравку и (или) перемешивать раствор.
2. Если температура не оказывает значительного влияния на изменение растворимости, иными словами, ТКР вещества крайне мал, пересыщение системы чаще всего задается путем испарения растворителя, с использованием различия в скоростях испарения растворителя и растворенного вещества. Особым требованием при этом является строгая изотермичность процесса, исключающая влияние температуры окружающей среды на процессы испарения и, соответственно, на кинетику кристаллизации. Схема установки, используемой в этом методе, представлена на рис. 3.8.
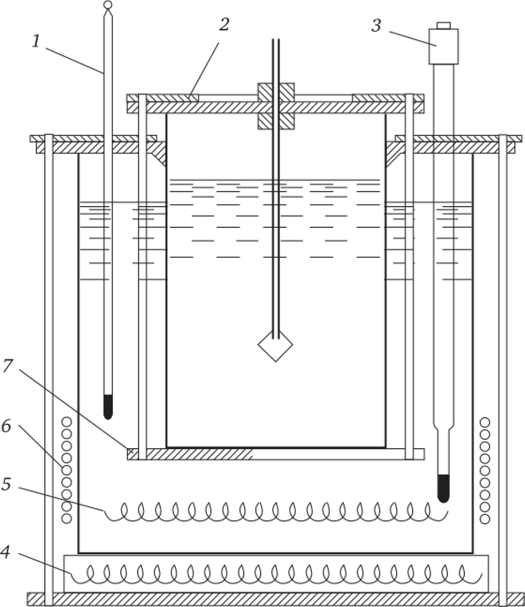
Рис. 3.7. Схема установки для выращивания кристаллов методом изменения температуры раствора (Совр. крист., 1980):
I — термометр; 2 — крышка кристаллизатора с винтами; 3 — терморегулятор;
- 4—6 — нагревательные элементы; 7 — подставка кристаллизатора
- 3. И наконец, вещества с крайне низкой растворимостью кристаллизуют за счет химических реакций. Для создания необходимой концентрации исходных компонентов в раствор переводят другие их, более растворимые, соединения. При этом химическое взаимодействие растворенных компонентов должно обеспечивать образование и кристаллизацию искомой малорастворимой твердой фазы. В кристаллизаторе создаются три зоны, разделенные полупроницаемыми перегородкамимембранами. Растворение исходных соединений происходит в двух крайних отсеках, и в результате диффузии кристаллообразующие компоненты попадают в среднюю зону с затравкой кристаллизуемого вещества. Скорости роста в этом методе определяются кинетикой реакций. Поэтому для повышения качества кристаллов либо используют слаборастворимые исходные соединения, либо регулируют поступление растворенного вещества в зону роста, например, повышением вязкости среды применением различных гелей (желатин, агар-агар, кремнезем и др.).
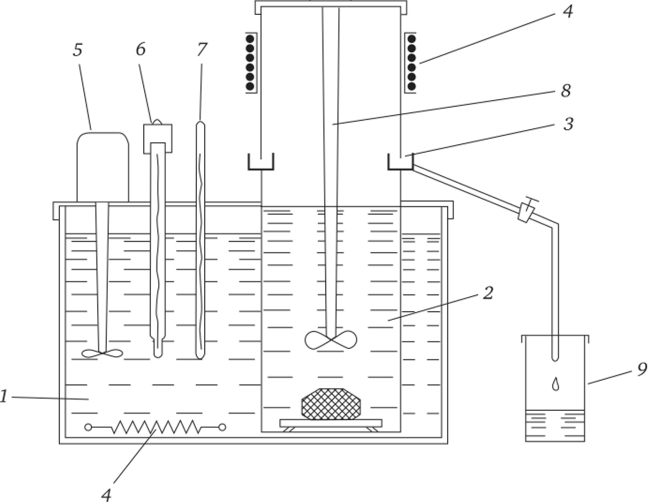
Рис. 3.8. Схема установки для выращивания кристаллов методом испарения растворителя (Совр. крист., 1980):
- 1 — водяной термостат; 2 — кристаллизатор; 3 — кольцо для слива конденсата;
- 4 — нагреватель; 5 — мешалка термостата; 6 — терморегулятор; 7 — термометр;
- 8 — мешалка кристаллизатора