Работа 4. Построение кривых растворимости

Для растворов важное значение имеет понятие растворимости данного вещества в том или ином растворителе. Как отмечалось выше, под растворимостью понимают максимальное количество вещества (предельная концентрация), способное растворяться при заданных условиях в определенном количестве растворителя. Растворимость зависит от природы растворителя и растворенного вещества и от условий растворения… Читать ещё >
Работа 4. Построение кривых растворимости (реферат, курсовая, диплом, контрольная)
Для растворов важное значение имеет понятие растворимости данного вещества в том или ином растворителе. Как отмечалось выше, под растворимостью понимают максимальное количество вещества (предельная концентрация), способное растворяться при заданных условиях в определенном количестве растворителя. Растворимость зависит от природы растворителя и растворенного вещества и от условий растворения.
Большинство методов выращивания кристаллов из растворов основано на использовании зависимости растворимости вещества от термодинамических параметров (см. параграф 3.3). Графическое представление температурной зависимости растворимости называется кривой растворимости.
При определении температуры насыщения t раствора заданной концентрации, используя один из классических приемов, в перегретый раствор помещают кристалл-индикатор. Затем раствор медленно охлаждают, фиксируя при этом температуру исчезновения нисходящих потоков «растворения» ta и температуру появления восходящих потоков «роста» кристаллов t2. Среднее арифметическое f 1 ^f2 = tH — это не что иное, как температура насыщения раствора заданной концентрации.
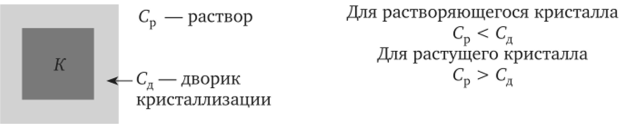
Оптический эффект сводится к различному преломлению света, проходящего через раствор и «дворик» кристаллизации для этих двух случаев.
Наблюдение за концентрационными потоками осуществляется при помощи оптического стенда, схематично приведенного на рис. 4.1. Луч света от точечного источника света S, проходя через линзу Ьь образует однородный пучок.
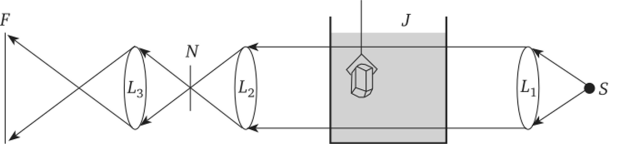
Рис. 4.1. Ход лучей в установке для наблюдения концентрационных.
потоков На его пути располагается плоскопараллельная кювета J с исследуемым раствором. В него погружается кристалл соли, растворимость которой определяется. Линза 12 дает изображение лампы в плоскости щели N. При этом условии любые неоднородности в исследуемом растворе, в частности концентрационные потоки вокруг помещенного в раствор кристалла, вызывают искривление лучей света, которые фокусируются на экране F. В результате получается изображение кристалла К и возникающих около него неоднородностей среды в виде концентрационных потоков. Наиболее точным метод становится в том случае, когда температура фиксируется не по исчезновению и появлению концентрационных потоков, а по погасанию ярко очерченного контура вокруг кристалла — «дворика» кристаллизации. Внутри этого слоя концентрация изменяется от насыщенной (у поверхности кристалла) до значения объемной концентрации, соответствующей данному раствору (на внешней поверхности слоя). Таким образом, «дворик» представляет собой оптическую неоднородность и четко виден на экране F.
Цель работы: построение кривой растворимости на примере алюмокалиевых квасцов или сегнетовой соли.
Материалы: сегнетова соль KNaC4H406-4H20, алюмокалиевые квасцы KA1(S04)2-12H20.
Инструменты: оптический стенд для наблюдения, термометр, весы, бумажный фильтр, термостойкая колба, воронка для фильтрования.
Описание работы
- 1. Приготовить и закрепить пробный кристалл.
- 2. Приготовить исходный (наиболее концентрированный) раствор исследуемого вещества, используя выражение массовой доли т (мае. %) через отношение массы твердого вещества (Ь) к массе всего раствора (а) т = Ь / а ? 100%. В выполняемой работе исходная концентрация раствора сегнетовой соли составляет 75 мае. %, а алюмокалиевых квасцов — 24 мае. %.
- 3. По описанной выше методике определить температуру насыщения раствора.
- 4. Путем разбавления исходного раствора приготовить 5—6 растворов с промежуточными концентрациями таким образом, чтобы концентрация каждого последующего раствора отличалась от предыдущего на 5 мае. %. Дополнительное количество X растворителя определяется из расчета Х = а (т / п — 1), где т — начальная, ап — последующая концентрации раствора.
- 5. Для каждого из полученных растворов определить температуру насыщения.
- 6. На основании полученных результатов построить кривую растворимости N=/(Г).
Вопросы к работе
- 1. Что такое растворимость?
- 2. Что понимают под фазовой диаграммой растворимости и что такое протяженность метастабильной области?
- 3. Что такое температурные коэффициенты растворимости и теплота растворения?
- 4. Какие известны методы определения растворимости?