Атом и атомное ядро

Самый нижний (основной) уровень энергии атома соответствует состоянию атома с наименьшей энергией — его основному, или нормальному состоянию; основное состояние атома наиболее устойчиво, в нём свободный, не подверженный внешним воздействиям атом может находиться неограниченно долго. Все остальные — возбуждённые состояния атома обладают большей энергией. В возбуждённое состояние атом может перейти… Читать ещё >
Атом и атомное ядро (реферат, курсовая, диплом, контрольная)
Открытие радиоактивности и последующие за ним интенсивные физические и химические исследования привели к созданию моделей строения атома, атомного ядра, а потом и «элементарных» частиц.
В данной главе приведена информация по строению атома и его ядра, необходимая для понимания причин устойчивости ядер по отношению к радиоактивному распаду.
Строение атома
Согласно атомно-молекулярному учению, химическое вещество состоит из молекул и атомов.
Молекула — наименьшая частица вещества, которая способна существовать самостоятельно и не может дробиться дальше без потери основных химических свойств данного вещества.
Атом (от др. греч. аторо<,; — неделимый) — мельчайшая частица химического элемента, сохраняющая его свойства.
Химический элемент — совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке. Каждый химический элемент имеет своё латинское название и химический символ, состоящий из одной или пары латинских букв.
Нуклид — разновидность атома, характеризуемая числом протонов и нейтронов, а в некоторых случаях энергетическим состоянием ядра. Нуклиды могут быть стабильными или нестабильньши, т. е. радиоактивными.
Радионуклид — нуклид, испускающий ионизирующее излучение.
Атом электронной оболочки, подразделённой на слои. Он состоит из тяжёлого ядра, обладающего положительным электрическим зарядом, и окружающих его лёгких электронов с отрицательными электрическими зарядами, образующих электронные оболочки, подразделённые на слои. Принадлежность атома данному элементу определяется величиной заряда — Ze (е — величина элементарного электрического заряда, Z — атомный номер). Число электронов в нейтральном атоме равно Z, их общий отрицательный заряд равен Ze. Теряя электроны, нейтральный атом превращается в ионизированный атом — положительно заряженный ион, а после присоединения одного или нескольких электронов — в отрицательный ион. Число электронов, которое атом потерял (присоединил), определяет кратность иона. Нейтральный атом обозначают символом элемента, для ионов к символу атома добавляют индексы справа сверху, например О2' - двухкратный отрицательный ион кислорода.
Табл. 1. Характерные порядки размеров в атоме.
Линейные размеры. | Площадь[1] | Объем. | |
Атом. | Ю-8 см | 10″16 см2 | 10″24 CAf3. |
Ядро. | 10~12 см | 10″24 см2 | 10"36 СМ’З |
Отношение. | Ю4 | Ю8 | Ю, а |
атома. Размеры атома могут быть получены из определения постоянной b в уравнении Ван-дер-Ваальса, средней длины свободного пробега в газе, из расстояния между атомами в кристаллической решётке (по данным рентгено-структурного анализа) или другими способами.
Радиус атома определяется радиусом электронной оболочки и равен «ю 8 см. Ядро — центральная, несущая основную массу, часть атома — имеет размеры «10‘13-г10*12см (l-rio ферми).
Ферми — единица измерения расстояния, применяющаяся в ядерной физике, названа в честь итальянского физика Энрико Ферми. Ферми отличается от фемтометра лишь названием. Обозначение: русское — фм, международное —fm. По величине ферми и фемтометр совпадают: 1-юм. Единица удобна для применения в ядерной физике, поскольку характерные размеры атомного ядра составляют несколько ферми. 1 ферми = 1 фм = 1-ю~15м = 1 фемтометр = 1 фм.
Масса атома в основном определяется массой его ядра и возрастает пропорционально массовому числу атома, т. е. общему числу протонов и нейтронов — числу нуклонов в ядре. Масса электрона (0,91-ю*2? г) в -1840 раз меньше протона или нейтрона, поэтому центр тяжести атома практически совпадает с ядром и можно считать, что в системе координат, связанной с атомом движутся только электроны, а ядро покоится.
Массу атома выражают в атомных единицах (а.е.м. — дальтонах). За 1 а.е.м. принята 1/12 часть массы атома углерода с массовым числом 12 (т.н. углеродная шкала). 1 а.е.м. = 1,6 605 655-кг2? кг. За атомную массу элемента, состоящего из смеси изотопов, принимают среднее значение атомной массы изотопов с учётом их процентного содержания. Атомная масса меньше суммы масс составляющих атом частиц (протонов, нейтронов, электронов) на величину, обусловленную энергией их взаимодействия (дефект массы).
Для перевода значений масс т частиц, выраженных в а.е.м., в единицу массы СИ (кг) пользуются формулой.
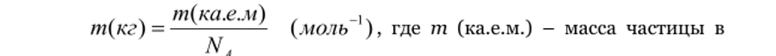
килоатомных единицах, Na =6,022-ю23 моль * - число Авогадро.
Атомы данного элемента могут отличаться массой ядра (число протонов Z постоянно, число нейтронов A-Z может меняться); такие разновидности А одного и того же элемента называются изотопами. Различие массы ядра слабо сказывается на строении их электронных оболочек, зависящем от заряда ядра Z. Химические и большинство физических, определяемые строением электронных оболочек, одинаковы или очень близки для всех изотопов данною элемента. Наибольшие отличия в свойствах (изотопные эффекты) получаются для изотопов водорода (Z = 1) из-за большой разницы в массах обычного лёгкого водорода (Л = 1), дейтерия (А = 2) и трития.
(А = 3).
Внутренняя энергия атома — его основная характеристика. Атом является квантовой системой, его внутренняя энергия квантуется — принимает дискретный (прерывный) ряд значений, соответствующих устойчивым, стационарным состояниям атома, промежуточные значения эта энергия принимать не может. Энергия изменяется только скачкообразно путём квантового перехода.
Замечание. Волновые свойства электрона, не позволяют ему иметь одну строго определенную энергию: энергия орбитального электрона всегда «размыта» в некотором диапазоне, так что энергетический уровень имеет конкретную ширину, всегда отличную от нуля. Важно, что ширина энергетического уровня зависит от типа химического соединения, в которое входит атом. Следует также помнить, что волновая функция любого электрона атома проходит через ядро. Поэтому' атомные свойства сказываются на ядерных, а ядерные — на атомных.
Поглощая определенную порцию энергии, атом переходит в возбужденное состояние (на более высокий уровень энергии). Из возбужденного состояния атом, испуская фотон, может перейти в состояние с меньшей энергией (на более низкий уровень энергии). Уровень соответствующий минимальной энергии атома называется основным, остальные — возбужденными. Квантовые переходы обусловливают атомные спектры поглощения и испускания, индивидуальные для атомов всех химических элементов.
Введение
квантовых чисел для атомных электронов позволило адекватно интерпретировать обычную и тонкую структуру оптических спектров. Объяснение сверхтонкой структуры оптического спектра можно получить только в с учетом свойств атомного ядра.
Уровни энергии — возможные значения энергии квантовых систем (атомов, молекул, кристаллов атомных ядер и т. д.), состоящих из микрочастиц и подчиняющихся законам квантовой механики. Внутренняя энергия квантовых систем может принимать только определённые дискретные значения: Ео, Et, (Eo2…), соответствующие устойчивым (стационарным) состояниям системы. Совокупность уровней энергии образует энергетический спектр системы — непрерывный, дискретный или смешанный.
Атомные спектры — оптические спектры свободных или слабо связанных атомов (одноатомных газов, паров), возникающие при излучательных квантовых переходах. Атомные спектры — линейчатые, состоят из отдельных спектральных линий, которые характеризуются определенной длиной волны и для простых атомов группируются в спеюпральные серии. Содержат информацию о строении атомов.
Спектральные линии — линии в спектрах электромагнитных излучений атомов, молекул и др. квантовых систем. Излучение, соответствующее данной спектральной линии характеризуется определённой длиной волны (и, следовательно, частотой). Каждая спектральная линия отвечает определенному квантовому переходу. В соответствии с наг}равлением перехода различают спектральные линии поглощения и испускания.
Квантовые переходы — скачкообразные переходы квантовой системы (атома, молекулы, атомного ядра) из основного возможного состояния в другое. Квантовые числа — целые или дробные числа, определяющие возможные дискретные значения физических величин, характеризующих квантовые системы (атомное ядро, атом, молекулу и др.) и отдельные элементарные частицы.
Самый нижний (основной) уровень энергии атома соответствует состоянию атома с наименьшей энергией — его основному, или нормальному состоянию; основное состояние атома наиболее устойчиво, в нём свободный, не подверженный внешним воздействиям атом может находиться неограниченно долго. Все остальные — возбуждённые состояния атома обладают большей энергией. В возбуждённое состояние атом может перейти из основного путём излучательного квантового перехода, поглотив квант электромагнитной энергии, или получив энергию от другой частицы при столкновении с ней (безызлучательный квантовый переход). Возбуждённые состояния имеют конечное время жизни (для свободного атома оно.
~ю-8 с), т.к. атом стремится перейти в состояние с меньшей энергией; при этом атом испускает фотон, энергия которого равна /zv=E, — ?* - энергии верхнего и нижнего уровней атома соответственно, v — частота испускаемого электромагнитного излучения. При обратном переходе с нижнего уровня на верхний атому должна быть сообщена энергия Ei-Ek. Каждому излучательному квантовом}' переход}' атома соответствует спектральная линия частоты v (или длины волны A=c/v), совокупность спектральных линий атома образует его спектр.
Квантование энергии атома является следствием волновых свойств электрона, которыми он (как и другие микрочастицы) обладает наряду с корпускулярными свойствами. Движению электрона в атоме соответствует стоячая волна с длиной Л"ю*8 см, т. е. порядка линейных размеров атома. Поскольку для стоячей волны в ограниченном объёме возможны лишь определённые значения Я, то и энергия атома также может принимать лишь дискретный ряд значений. Свободный электрон, оторванный от атома, имеет непрерывный энергетический спектр.
- [1] Поперечное сечение атома. Размеры атома определяются размерами его электронной оболочки, не имеющей строго определённых границ, поэтому' значения радиуса иобъёма атома зависят от способа их экспериментального определения (значения радиусов атомов весьма разнообразны). Они определяются размерами электронной оболочки атома и велики по сравнению с размерами ядра