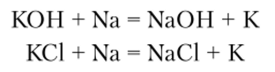В силу своей химической активности щелочные металлы встречаются в природе исключительно в виде соединений.
Литий встречается более чем в 150 минералах, из которых около 30 считаются собственными минералами лития. Промышленное значение для получения лития имеют сподумен LiAl (Si03)2, лепидолит (литиевая смола) Li2Al2(Si03)8(F; ОН)2 (такая форма записи с перечислением элементов в скобках принята для вещества неустановленного состава).
Натрий в природе распространен широко. Из соединений, имеющих важное промышленное значение, следует отметить поваренную соль NaCl; глауберову соль Na2S04 • 10Н2О; чилийскую селитру NaN03; криолит Na3AlF6; буру Na2Bi07— 10Н2О.
Калий в природе распространен несколько меньше, чем натрий. В земной коре встречается в форме минералов: сильвин КС1; карналлит КС1 • MgCl2 • 6Н20; каинит КС1 • MgSO, • ЗН20.
Почти 18% массы земной коры приходится на долю калий содержащего минерала — ортоклаза К20- Al203 -6Si02.
Рубидий и цезий встречаются в ничтожно малых количествах. Как правило, они сопутствуют минералам калия и натрия.
Франций — самый тяжелый и самый активный щелочной металл. Он радиоактивен. Период полураспада самого долгоживущего изотопа франция — 22 мин.
Металлические литий, натрий и калий получают электролитическим восстановлением расплавленных солей или соответствующих гидроксидов. Литий получают электролизом смеси хлорида и фторида (LiCl и LiF) или расплава эвтектической смеси LiCl—КС1. Натрий получают электролизом расплавленного NaCl и очень редко NaOH. При получении натрия из NaCl обычно для снижения температуры плавления электролита добавляют КС1, СаС12, NaF. В промышленности калий получают обменными реакциями между металлическим натрием и КОН или же КС1 соответственно:
В первом случае реакция идет между расплавленным гидрооксидом КОН и жидким Na — противотоком в тарельчатой реакционной колонке из никеля при 380—440°С. Во втором случае через расплавленную соль КС1 пропускают пары Na при 760—800°С; выделяющиеся пары калия конденсируют.
Рубидий и цезий получают восстановлением их из хлоридов с помощью металлического кальция или термическим разложением их соединений.