Элементы 4-й группы

В обычных условиях Ti, Zr и Hf из-за наличия защитной пленки оксида на поверхности устойчивы к воздействию коррозирующих реагентов, однако при нагревании их активность значительно повышается и уже при температуре красного каления они сгорают с образованием оксидов Ме09. Взаимодействие с галогенами также протекает при нагревании до 150—400°С и сопровождается образованием галогенидов МеНа14. При… Читать ещё >
Элементы 4-й группы (реферат, курсовая, диплом, контрольная)
К элементам 4-й группы относятся титан Ti, цирконий Zr, гафний Hf и резерфордий Rf, являющиеся полными электронными аналогами и составляющие группу титана.
Историческая справка Впервые об элементе с порядковым номером 22 было сообщено в 1791 г. английским химиком У. Грегором. Четыре года спустя М. Клапрот обнаружил новый элемент в минерале рутиле. Однако ни тому пи другому получить элементарный титан не удалось, а выделенный ими порошок оказался оксидом ТЮ2. Лишь в 1875 г. Д. К. Кирилловым был получен металлический титан.
В 1789 г. Клапрот впервые получил оксид циркония, а спустя 35 лет Й. Я. Берцелиусу удалось получить металлический цирконий.
Гафний был открыт в 1923 г. Д. Хевеши и Д. Костером в минерале цирконе. Элемент с порядковым номером 104 синтезирован в США и назван в честь выдающегося физика Э. Резерфорда резерфордием Rf.
Отличаясь в строении атомов числом внутренних электронных оболочек, элементы группы титана характеризуются одинаковой электронной конфигурацией nd2ns2:
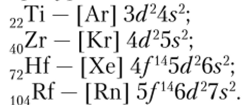
Основные константы титана и его аналогов приведены в табл. 5.2.
Таблица 5.2
Физические константы элементов 4-й группы.
Символ. | Атомная масса. | М сталл ически й радиус атома, им. | Условный радиус иона Me4*, им. | Энергия ионизации Ме° — Ме+, эВ. | Плотность, г/см3 |
Ti. | 47,90. | 0,146. | 0,064. | 6,82. | 4,50. |
Zr. | 91,22. | 0,160. | 0,082. | 6,84. | 6,45. |
Hf. | 178,4. | 0,157. | 0,082. | 7,5. | 13,1. |
Rf*. | |261]. | 0,160. | 0,078. | ; |
* Данные для Rf теоретически расчетные.
Данные табл. 15.2, характеризующие элементы группы титана, показывают, что при переходе от Ti к цирконию увеличиваются атомный и ионный радиусы, а у Zr, Hf и Rf эти величины одинаковые или очень близкие, что объясняется лантаноидным сжатием. С ростом заряда ядра устойчивая степень окисления повышается: для титана и его аналогов наиболее характерна степень окисления +4, хотя для титана известны и соединения, в которых он проявляет степень окисления +2, +3 (TiO, Ti203, TiF2, TiF3). Для циркония и гафния степень окисления наиболее устойчивая.
Элементы группы титана проявляют координационные числа 4 и б (титан) и 7 и 8 (цирконий и гафний).
Свойства элементов 4-й группы. В виде простых веществ титан, цирконий и гафний представляют собой серебристо-белые металлы. Все они тугоплавки и существуют в двух полиморфных модификациях — аир. При низких температурах преобладает a-модификация, имеющая гексагональную решетку, а при высоких температурах существует p-модификация, характеризующаяся кубической объемно-центрированной решеткой.
В обычных условиях Ti, Zr и Hf из-за наличия защитной пленки оксида на поверхности устойчивы к воздействию коррозирующих реагентов, однако при нагревании их активность значительно повышается и уже при температуре красного каления они сгорают с образованием оксидов Ме09. Взаимодействие с галогенами также протекает при нагревании до 150—400°С и сопровождается образованием галогенидов МеНа14. При 800 °C они активно реагируют с азотом с образованием нитридов 3N. Титан при нагревании растворяется в НС1, и в среде Н20 образуются аквакомплексы [Ti (H20)6]2+:
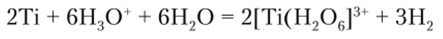
На цирконий и гафний концентрированная НС1 существенно не действует.
Безводный жидкий HF образует на поверхности металлов плотную пленку MeF4, предохраняющую металл от дальнейшего окисления. Газообразный HF действует на Ti, Zr и Hf при нагревании с образованием MeF4. Водные растворы плавиковой кислоты являются наиболее активными растворителями металлов. Так, мелкораздробленные Ti, Zr и Hf легко взаимодействуют с образованием комплексных анионов | MeF6J2b:
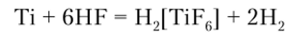
Титан, цирконий и гафний растворяются в царской водке, а также в смеси HF + HN03 и концентрированной H2S04 при нагревании:
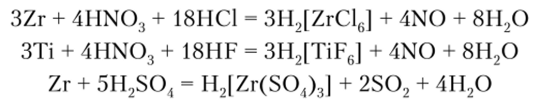
Металлы подгруппы титана устойчивы к растворам щелочей. Для соединений титана наиболее характерны следующие типы пространственных структур:
Ti (II) — октаэдрическая Ti (III) — октаэдрическая. | В большинстве соединений и в растворе. |
Ti (IV) — тетраэдрическая: TiCl. | 4; октаэдрическая: ТЮ2 и комплексы Ti (IV). |
Существенные отличия циркония и гафния от титана заключаются в следующем:
- а) наиболее распространенными для Zr и Hf являются соединения со степенью окисления +4; существует несколько соединений со степенью окисления ниже +4;
- б) ионы Zr4+ и НР+ обладают высоким зарядом; у них нет частично заполненной ^/-оболочки, обусловливающей преимущества какой-либо одной пространственной структуры. В связи с этим в комплексных соединениях координационные числа 7 и 8 для них более характерны, чем 6;
- в) несмотря на то что для Zr известна степень окисления +3 (например, в галогенидах), все же эта степень окисления встречается реже, чем у титана.
Из оксидов подгруппы титана наиболее устойчивы оксиды Ме02, обладающие амфотерными свойствами с преобладанием основных, усиливающихся в ряду ТЮ2 — Zr02 — НЮ2. В этом же направлении ослабевают окислительные свойства, слабо выраженные у ТЮ2. Оксиды Ме02 имеют координационные кристаллические решетки и в химическом отношении инертны. Вода, разбавленные кислоты (кроме HF) и щелочи на них не действуют. С кислотами взаимодействие может произойти только при длительном нагревании, а со щелочами — лишь при сплавлении.
Гидроксиды Me (IV) представляют собой студенистые осадки переменного состава Ме02 • /?Н903, что зависит от условий получения. Так, в свежем виде гидроксиды характеризуются большим числом ОН-групи, которые при старении постепенно замещаются на оксоловые группы. Свежие гидроксиды более реакционноспособны, чем состарившиеся осадки.
Гидроксид титана обладает амфотерными свойствами и поэтому растворяется в концентрированных щелочах. Гидроксиды циркония и гафния со щелочами практически не взаимодействуют; основные свойства гидроксидов усиливаются в ряду Ti (OH)4 — Zr (OH)4 — Hf (OH)4.
Из-за большого заряда гидратированные ионы Ti4+, Zr4" и Hf4+ в растворах существовать не могут, чем и объясняется легкая гидролизуемоегь растворимых солей этих металлов. Процесс гидролиза сопровождается вначале координационным насыщением, например TiCl4 до TiCl2-2H20, с последующим отщеплением НС1:
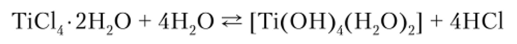
Затем образуются полимерные оловые и оксоловые комплексы (рис. 5.1).
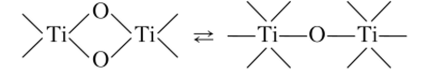
Рис. 5.1. Полимерные оловые и оксоловые комплексы титана.
С течением времени происходит дальнейшая полимеризация, поэтому полиядерные комплексы образуют коллоидные частицы.
Если в растворе имеются анионы, то в многоядерных комплексах молекулы Н90 и ОН-групиы могут замещаться на эти анионы и образовывать оксоили гидроксосоли, например Ti0S04II20, (NII4)2 Ti0(C904)2 -Н20. Поэтому вместо дискретного иона обычно образуются цепочки или кольца (Ti—О—Ti—0)х,.
Растворы, полученные растворением металла или его гидроксида в плавиковой кислоте, содержат анионные комплексы типа |MeFG|2, которые способны образовывать кристаллические соли. Из растворов TiCl4, насыщенных НС1, можно получить соли анионного комплекса [TiClrJ2. Остальные анионные комплексы могут быть получены сплавлением соответствующих соединений:
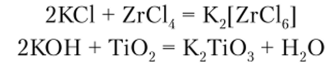
Одна из наиболее характерных реакций водных растворов солей титана и циркония — образование пероксокомплексов в присутствии Н202:
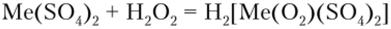
Пероксокомплексы титана имеют интенсивную оранжевую окраску, что и используется в аналитической химии для обнаружения Ti (IV).
Соединения Ti (III) обычно получают осторожным восстановлением соединений Ti (IV). Титан образует оксид Ti203, который при взаимодействии с водными растворами кислот образует аквакомплексы типа [Ti (H20)6]3+.
Растворы Ti (III) являются мягкими восстановителями:
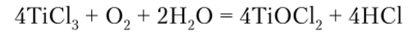
Для них характерны и реакции диспропорционирования:
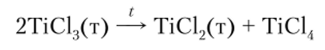
TiCl2, будучи сильным восстановителем, далее диспропорционирует:
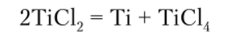
Химия соединений Zr3" и IIР+ изучена очень слабо.