Алюминий.
Химия элементов

По практическому применению алюминий занимает одно из первых мест среди металлов. Важнейшая область применения алюминия — производство легких сплавов на его основе. Алюминий используется как самая распространенная легирующая добавка в сплавах на основе меди, магния, титана, никеля, цинка и железа. В виде чистого металла алюминий используется для изготовления химической аппаратуры, электрических… Читать ещё >
Алюминий. Химия элементов (реферат, курсовая, диплом, контрольная)
Историческая справка Алюминий в металлическом состоянии был впервые получен Г. Эрстедом в 1825 г. восстановлением безводного хлорида алюминия амальгамой калия. В 1827 г. Ф. Вёлер, усовершенствовав метод, заменил амальгаму металлическим калием.
Алюминий — самый распространенный в природе металл (общее содержание в земной коре составляет около 8%). Он входит в состав силикатов (шпаты, слюды), а также глин, образующихся из полевых шпатов при их естественном разрушении. Из соединений алюминия наибольшее значение имеют А1203 (корунд, рубин, сапфир), ортоклаз KAlSi3O10, альбит NaAlSi3OI0, анортит Са (А15Ю4)2, нефелин KNaAlSiO^, криолит Na3AlFG, боксит А1203-яН20.
Современный промышленный способ получения алюминия сводится к электролизу оксида алюминия А1203. Последний не проводит электрический ток и имеет высокую температуру плавления, поэтому его растворяют в расплавленном криолите Na3AlFG с одновременной добавкой фторидов (CaF2, MgF2 или A1F3).
Свойства алюминия и его соединений. Алюминий — серебристо-белый металл, имеющий гранецентрированную решетку. Плотность алюминия 2,7 г/см3. Он относится к легким металлам и обладает высокой электрои теплопроводностью.
Атом алюминия, имеющий электронную конфигурацию s22s22p63s23p имеет значительно большие металлический и ионный радиусы, чем бор, но характеризуется меньшей энергией ионизации. Поэтому у алюминия явно преобладают металлические признаки, а неметаллические выражены в меньшей степени, чем у бора.
Для алюминия, как и для бора, более характерна степень окисления +3, а координационные числа равны 4 и 6. Обладая большим сродством к кислороду, алюминий очень легко окисляется с образованием оксида А1203:
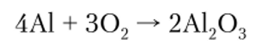
На воздухе в результате такого окисления на поверхности алюминия образуется защитная пленка оксида, плотно связанная с поверхностью металла. Этим и объясняется высокая стойкость алюминиевых изделий в атмосферных условиях, по отношению к морской воде и т. д. Пленка оксида предохраняет металл от дальнейшего окисления. Если снять слой оксида с поверхности металла, то алюминий энергично реагирует с водой, вытесняя водород:
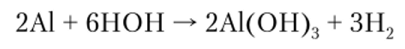
В концентрированных азотной и серной кислотах на холоде алюминий пассивируется вследствие образования защитной пленки А12Оэ. С другими же минеральными кислотами алюминий взаимодействует легко, вытесняя водород и образуя катионные комплексы.
Будучи амфотерным, алюминий легко взаимодействует и с растворами кислот и щелочей, образуя катионные и анионные комплексы, вытесняя при этом водород:
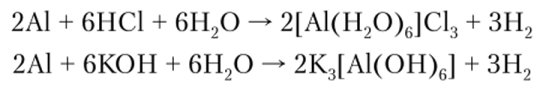
При комнатной температуре алюминий реагирует с галогенами, образуя соли соответствующих галогеноводородных кислот:
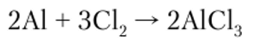
Алюминий восстанавливает многие металлы из их оксидов. Это свойство алюминия находит широкое применение для получения металлов (алюминотермия):
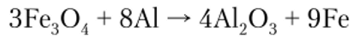
Оксид алюминия А1903 существует в виде нескольких полиморфных модификаций, структура которых зависит от условий получения. Имеются две безводные формы — а-А1203 и у-А1203. Обе формы построены как плотные упаковки оксид-ионов, но различаются положением катионов.
а-А1203 характеризуется ромбоэдрической решеткой; в его кристаллах наблюдается октаэдро-тетраэдрическая координация. Эта форма устойчива при высоких температурах, но в то же время термодинамически неустойчива при низких температурах. Встречается в природе в виде минерала корунда. а-А12Оэ — твердое вещество, устойчивое к действию кислот и не способное к гидратации.
у-Форма легко поглощает воду и растворяется в кислотах. у-А12Оэ имеет амфотерный характер, причем основные свойства выражены сильнее, чем кислотные.
А12Оэ при взаимодействии с растворами щелочей образует гидроксоалюминаты:
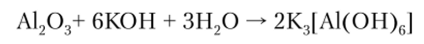
Сплавление А12Оэ со щелочами приводит к образованию метаалюминатов:
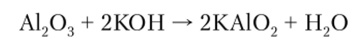
Гидсоксид алюминия А1(ОН)3 — полимерное соединение, имеющее слоистую кристаллическую решетку, где слои состоят из октаэдров и соединены между собой водородными связями.
А1(ОН)3 может быть в двух видоизменениях: в кристаллической форме — бесцветные кристаллы моиоклинической системы, или в аморфной — белый студенистый осадок, получаемый при осаждении гидроксида из растворов солей алюминия щелочами.
Получение А1(ОН)3 состоит из последовательных стадий замещения молекул воды в аквакомплексе на ионы ОН :
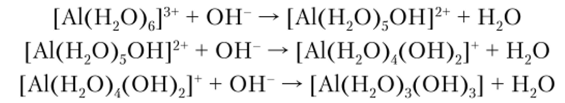
Одновременно с этим процессом происходит полимеризация, приводящая в конечном итоге к образованию осадка переменного состава А1203 яН20 (рис. 11.8).
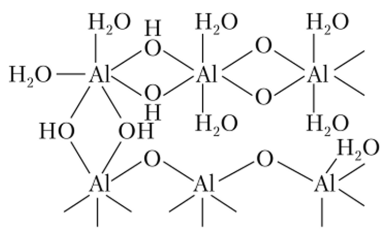
Рис. 11.8. Структура Al203 wH20.
Со временем осадок постепенно переходит в кристаллический А1(ОН)3. При прокаливании А1203 /?Н20 постепенно теряет воду, превращаясь в конечном итоге в А1203. В процессе дегидратации получаются промежуточные соединения, структура которых зависит от исходного продукта и условий обезвоживания. Некоторые из них содержат мостики ОН и поэтому легко растворяются в кислотах и шелочах. В других же эти ОН-группы за;
мещены на атомы О, поэтому они химически малоактивны и со щелочами взаимодействуют лишь при сплавлении. А1(ОН)3 практически нерастворим в воде и является типичным амфотерным гидроксидом. Взаимодействуя с кислотами и щелочами, он образует комплексные катионы или анионы соответственно:
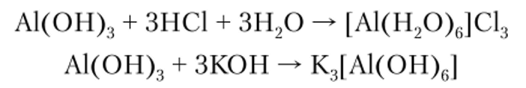
Способность к образованию комплексных катионов и анионов можно представить схемой.
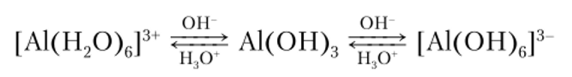
Из кислых растворов соли алюминия кристаллизуются в виде кристаллогидратов, например А1С13*6Н20, KAl (SO/l)2— 12Н20 и т. д.
Галогениды алюминия известны для всех четырех галогенов. AlF3 является высокоплавким ионным соединением, а А1С13, А1Вг3 и АИ3 имеют более низкие температуры плавления. В парах А1С13 димерен. Димерная структура преобладает в газовой фазе при температурах, близких к температуре кипения. Дальнейшее нагревание приводит к диссоциации с образованием тригональных мономерных молекул. За исключением AlF3, остальные галогениды алюминия относятся к сильным кислотам Лыоиса.
Галогениды алюминия (кроме A1F3) в отличие от типичных солей обладают большей реакционной способностью. При взаимодействии с водой они гидролизуются, что сопровождается значительным выделением теплоты. Гидролиз обычно неполный и обратимый, а реакция среды кислая:
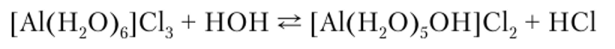
Комплексные соединения алюминия могут быть катионными, например [А1(Н70)к]3+, анионными, например [AlF(.]3", или нейтральными, например A1C13[(NH3)3]6.
В анионных комплексах, образованных A1F3, координационное число может быть равно 4,5,6, что соответствует галогеналюминитам типа Ме3| A1FJ, Me.}[AlF5] и Ме~А1На14. Наиболее устойчивым является криолит Na3[AlF6], кристаллы которого образованы ионами Na+ и [AlF6]3~. Алюминаты типа Me2[AlF5] и Ме+А1На14 образованы полимерными фторалюминатными комплексами.
В хлоро-, бромои иодоалюминатах координационное число алюминия обычно равно 4, например К[А1С1 J.
Фтороалюминаты щелочных металлов в воде растворяются с трудом, в противололожность им ионы [A1C1J", [AlBrJ и [АНД легко гидролизуются, поэтому в водных растворах соли, образованные этими анионами, разлагаются.
Важным соединением алюминия является гидрид (алан) А1Н3, который получают косвенно из гидридоалюминатов: 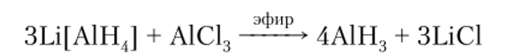
Гидрид алюминия — полимерное соединение (AlH3)w и, подобно гидриду бора, электронодефицитен. А1Н3 имеет сетчатое строение: атомы алюминия располагаются в октаэдрическом окружении атомов водорода, и каждая пара соседних атомов алюминия связана двумя трехцентровыми двухэлектронными связями через атомы водорода сверху и снизу от плоскости сетки из атомов алюминия.
Гидрид алюминия реагирует с основными гидридами, образуя аланаты:
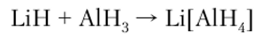
Гидрид-анион |A1HJ имеет тетраэдрическое строение, сходное со строением [ВН4]. Тетрагидроалюминат лития — наиболее важное соединение в ряду подобных комплексов.
Гидридоалюминаты — белые, кристаллические вещества. Они применяются в органическом синтезе в качестве восстановителей.
Ион алюминия обнаруживают с помощью реакции пиролиза. Смоченное раствором нитрата кобальта небольшое количество гидроксида алюминия образует после прокаливания сплав, окрашенный в синий цвет вследствие образования метаалюмината кобальта (тенаровой сини) — Со (А102)2:
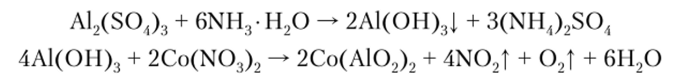
По практическому применению алюминий занимает одно из первых мест среди металлов. Важнейшая область применения алюминия — производство легких сплавов на его основе. Алюминий используется как самая распространенная легирующая добавка в сплавах на основе меди, магния, титана, никеля, цинка и железа. В виде чистого металла алюминий используется для изготовления химической аппаратуры, электрических проводов. Алюминиевая фольга применяется для изготовления конденсаторов. Не менее важно использование алюминия для защиты металлов от коррозии.
Соединения алюминия используются и в медицинской практике. Оксид алюминия входит в состав бентонитовых глин, которые широко используются в стоматологии. А1(ОН)3 применяют в качестве адсорбирующего и обволакивающего средства: наружно — для присыпок, внутрь — при лечении язвенной болезни, острых и хронических гастритов, характеризующихся повышенной кислотностью желудочного сока, так как он обладает антацидным действием. Входит в состав препарата алмагелъ.
Квасцы — KA1(S04)2— 12Н20 применяют наружно как кровоостанавливающее средство.