Лекция 8. Арены (ароматические углеводороды)

У гомологов бензола в результате влияния бокового радикала (+I-эффект, электронодонорная группа) р-электронная плотность бензольного кольца распределена неравномерно, увеличиваясь в 2,4,6-положениях. Поэтому SЕ -реакции протекают направлено (в 2,4,6- или о- и п-положения). Гомологи бензола по сравнению с бензолом в реакциях этого типа проявляют большую реакционная активность. Аренами называют… Читать ещё >
Лекция 8. Арены (ароматические углеводороды) (реферат, курсовая, диплом, контрольная)
План.
- 1. Классификация ароматических углеводородов.
- 2. Гомологический ряд моноциклических аренов, номенклатура, получение.
- 3. Изомерия, строение бензола и его гомологов.
- 4. Свойства аренов.
Аренами называют богатые углеродом циклические углеводороды, которые содержат в молекуле бензольное ядро и обладают особыми физическими и химическими свойствами. Арены по числу бензольных колец в молекуле и способа соединения циклов подразделяют на моноциклические (бензол и его гомологи) и полициклические (с конденсированными и изолированными циклами) соединения.
Арены бензольного ряда можно рассматривать как продукты замещения атомов водорода в молекуле бензола на алкильные радикалы. Общая формула таких аренов СnH2n-6. В названии монозамещенных аренов указывают название радикала и цикла (бензол):
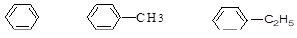
бензол метилбензол (толуол) этилбензол.
В более замещенных аренах положение радикалов указывают наименьшими цифрами, в дизамещенных аренах положение радикалов называют: 1,2 — орто (o-)-, 1,3 — мета (м-) — и 1,4 — пара (п-)-:

1,3-диметилбензол 1,2-метилэтилбензол.
м-диметилбензол (м-ксилол) о-метилэтилбензол (о-ксилол) Для аренов широко распространены тривиальные названия (некоторые названия указаны в скобках).
Нахождение в природе.
Ароматические углеводороды встречаются в растительных смолах и бальзамах. Фенантрен в частично или полностью гидрированном виде содержится в структурах многих природных соединений, например стероидов, алкалоидов.
Получение аренов:
- 1. сухая перегонка каменного угля;
- 2. дегидрирование циклоалканов
3. дегидроциклизация алканов с 6 и более атомами углерода в составе.
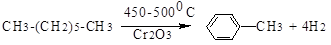
4. алкилирование.
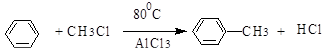
5. декарбоксилирование и восстановление кислородсодержащих сое динений.
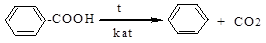
Изомерия. Для гомологов бензола характерна структурная изомерия: различное строение углеродного скелета бокового радикала и различные состав и расположение радикалов в бензольном кольце. Например, изомеры ароматических углеводородов состава С9Н12 (пропилбензол, изопропилбензол, о-метилэтилбензол и 1,2,4-триметилбензол):
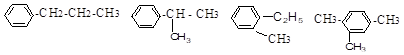
Строение. Ароматические углеводороды имеют целый ряд особенностей в электронном строении молекул.
Структурную формулу бензола впервые предложил А. Кекуле. Это шестичленный цикл с чередующимися двойными и одинарными связями, при этом двойные связи перемещаются в структуре:

В обеих формулах углерод четырехвалентен, все атомы углерода равноценны и дизамещенные бензола существуют в виде трех изомеров (орто-, мета-, пара-). Однако такая структура бензола противоречила его свойствам: бензол не вступал в характерные для непредельных углеводородов реакции присоединения (например, брома) и окисления (например, с перманганатом калия), для него и его гомологов основной тип химического превращения — реакции замещения.
Современный подход к описанию электронного строения бензола разрешает это противоречие следующим образом. Атомы углерода в молекуле бензола находятся в sр2-гибридизации. Каждый из атомов углерода образует три ковалентные у-связи — 2 связи с соседними атомами углерода (sр2-sр2-перекрывание орбиталей) и одну с атомом водорода (sр2-sперекрывание орбиталей). Негибридизованные р-орбитали за счет бокового перекрывания образуют р-электронную сопряженную систему (р, р-сопряжение), содержащую шесть электронов. Бензол представляет собой плоский правильный шестиугольник с длиной связи углерод-углерод 0,14нм, связи углерод-водород 0,11нм, валентными углами 1200 :
Молекула бензола стабильнее циклических соединений с изолированными двойными связями, поэтому бензол и его гомологи склонны к реакциям замещения (бензольное кольцо сохраняется), а не присоединения и окисления.
Сходство в строении и свойствах (ароматичность) с бензолом проявляют и другие циклические соединения. Критерии ароматичности (Э. Хюккель, 1931 г.):
а) плоская циклическая структура, т. е. атомы, образующие цикл, находятся в sр2-гибридизации; б) сопряженная электронная система; в) число электронов (N) в кольце равно 4n+2, где n — любое целочисленное значение — 0,1,2,3 и т. д.
Критерии ароматичности применимы как к нейтральным, так и заряженным циклическим сопряженным соединениям, поэтому ароматическими соединениями будут, например:
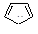


фуран катион циклопропенила.
Для бензола и других ароматических соединений наиболее характерны реакции замещения атомов водорода при углеродных атомах в цикле и менее характерны реакции присоединения по р-связи в цикле.
Физические свойства.
Бензол и его гомологи являются бесцветными жидкостями и кристаллическими веществами со своеобразным запахом. Они легче воды и плохо в ней растворяются. Бензол неполярное соединение (м=0), алкилбензолы ;
полярные соединения (м?0).
Химические свойства.
Электрофильное замещение. Наиболее характерным превращением для аренов является электрофильное замещение — SЕ. Реакция протекает в две стадии с образованием промежуточного у-комплекса:
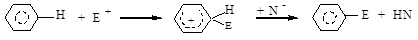
Условиях реакции: температура 60−800С, катализаторы — кислоты Льюса или минеральные кислоты.
Типичные SЕ — реакции:
а) галогенирование (Cl2, Br2):
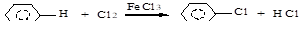
б) нитрование:
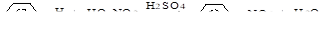
в) сульфирование (H2SO4, SO3, олеум):
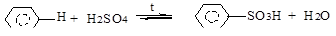
г) алкилирование по Фриделю-Крафтсу (1877г.)(RНal, ROH, алкены):
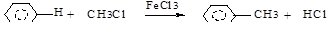
д) алкилирование по Фриделю-Крафтсу (галогенангидриды, ангидриды карбоновых кислот):
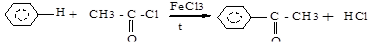
У гомологов бензола в результате влияния бокового радикала (+I-эффект, электронодонорная группа) р-электронная плотность бензольного кольца распределена неравномерно, увеличиваясь в 2,4,6-положениях. Поэтому SЕ -реакции протекают направлено (в 2,4,6- или о- и п-положения). Гомологи бензола по сравнению с бензолом в реакциях этого типа проявляют большую реакционная активность.
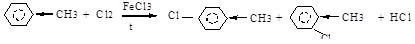
толуол п-хлортолуол о-хлортолуол Реакции боковых радикалов в алкилбензолах (радикальное замещение — SR и окисление).
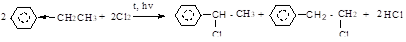
Реакции радикального замещения протекают, как и в предельных углеводородах, по цепному механизму и включают стадии инициирования, роста и обрыва цепи. Реакция хлорирования протекает ненаправлено, реакция бромирования региоселективна — замещение водорода происходит у б-углеродного атома.
В алкилбензолах боковая цепь окисляется перманганатом калия, бихроматом калия с образованием карбоновых кислот. Независимо от длины боковой цепи, окисляется атом углерода, связанный с бензольным ядром (б-углеродный или бензильный атом углерода), остальные атомы углерода окисляются до СО2 или карбоновых кислот.
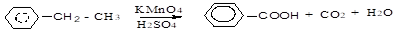
этилбензол бензойная кислота.
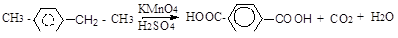
п-метилэтилбензол терефталевая кислота Реакции бензола с нарушением ароматической системы.
Ароматические углеводороды имеют прочный цикл, поэтому реакции с нарушением ароматической системы (окисление, радикальное присоединение) протекают в жестких условиях (высокие температуры, сильные окислители).
- а) радикальное присоединение:
- 1. гидрирование
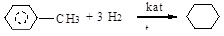
толуол циклогексан.
2. хлорирование.
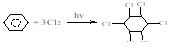
бензол 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Продукт этой реакции представляет смесь пространственных изомеров.
Ориентация электрофильного замещения в ароматических соединениях. Заместители в бензольном кольце по своему ориентирующему влиянию делятся на два типа: орто-, пара-ориентанты (заместители 1 рода) и мета-ориентанты (заместители 2 рода).
Заместители 1 рода — это электронодонорные группы, которые повышают электронную плотность кольца, увеличивают скорость реакции электрофильного замещения и активируют бензольное кольцо в этих реакциях:
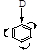
D (+I-эффект): — R, -СН2ОН, -СН2NН2 и т. д.
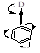
D (-I,+М-эффекты): -NH2,-OH, -OR, -NR2, -SH и т. д.
Заместители 2 рода — электроноакцепторные группы, которые понижают электронную плотность кольца, уменьшают скорость реакции электрофильного замещения и дезактивируют бензольное кольцо в этих реакциях:
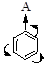
А (-I-эффект): -SO3H, -CF3, -CСl3 и т. д.
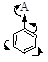
А (-I, -Мэффект): -НС=О, -СООН, -NO2 и т. д.
Атомы галогенов занимают промежуточное положение — они понижают электронную плотность кольца, уменьшают скорость реакции электрофильного замещения и дезактивируют бензольное кольцо в этих реакциях, однако это о-,п-ориентанты.
Если в бензольном кольце находится два заместителя, то их ориентирующее действие может совпадать (согласованная ориентация) или не совпадать (несогласованная ориентация). В реакциях электрофильного замещения соединения с согласованной ориентацией образуют меньшее количество изомеров, во втором случае образуется смесь из большего числа изомеров. Например:

п-гидроксибензойная кислота м-гидроксибензойная кислота.
(согласованная ориентация) (несогласованная ориентация) Полициклические конденсированные ароматические углеводороды (нафталин, антрацен, фенантрен и т. д.), в основном, по свойствам похожи на бензол, но вместе с тем имеют некоторые отличия.
Применение:
- 1. ароматические углеводороды — сырье для синтеза красителей, взрывчатых веществ, лекарственных препаратов, полимеров, поверхностно-активных веществ, карбоновых кислот, аминов;
- 2. жидкие ароматические углеводороды хорошие растворители органических соединений;
- 3. арены — добавки для получения высокооктановых бензинов.
Знаете ли вы, что.
- -В 1649 году немецкий химик Иоганн Глаубер впервые получил бензол.
- -В 1825 году М. Фарадей выделил из светильного газа углеводород и установил его состав — С6Н6.
- -В 1830 году Юстус Либих назвал полученное соединение бензолом (от араб. Вen-аромат + zoa-сок + лат. ol[eum]-масло).
- -В1837 году Огюстом Лораном назван радикал бензола С6Н5 — фенил (от греч phenix-освещать).
- -В 1865 году немецкий химик-органик Фридрих Август Кекуле предложил формулу бензола с чередующимися двойными и одинарными связями в шестичленном цикле.
- -В 1865−70-х годах В. Кернер предложил использовать приставки для обозначения взаимного расположения двух заместителей: 1,2 положение — орто- (orthos — прямой);1,3- мета (meta — после) и 1,4- пара (para — напротив).
- -Ароматические углеводороды — высокотоксичные вещества, вызывают отравление и поражение некоторых органов, например почек, печени.
- -Некоторые ароматические углеводороды — канцерогены (вещества, вызывающие раковые заболевания), например бензол (вызывает лейкемию), один из сильнейших — бензопирен (содержится в табачном дыме).